Содержание
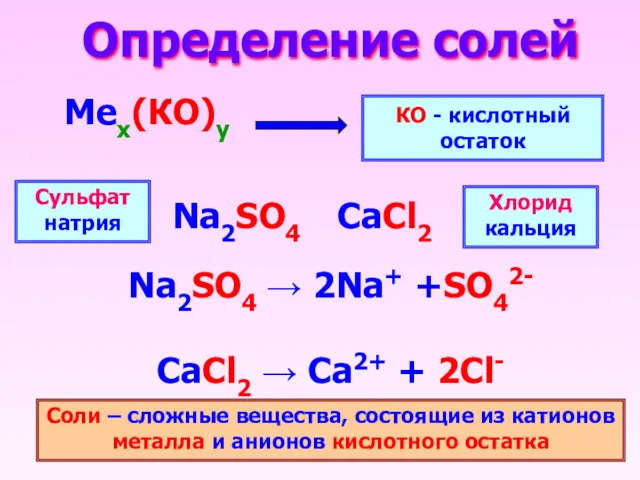
- 2. Определение солей Мех(КО)у КО - кислотный остаток Na2SO4 → 2Na+ +SO42- CaCl2 → Ca2+ + 2Cl-
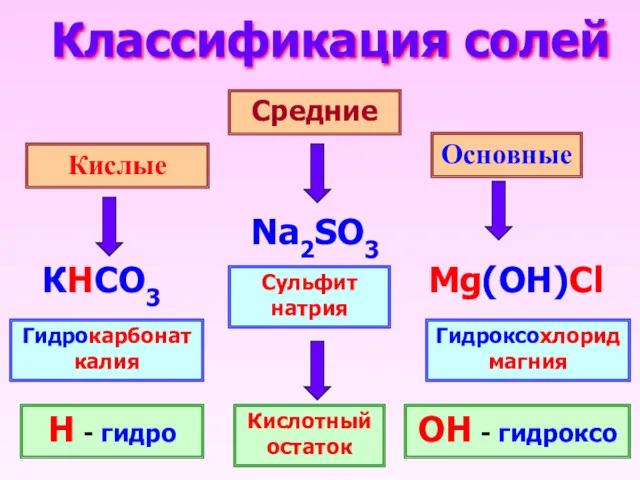
- 3. Классификация солей Кислые Средние Основные Na2SO3 КHCO3 Mg(OH)Cl Сульфит натрия Гидроксохлорид магния Гидрокарбонат калия Н -
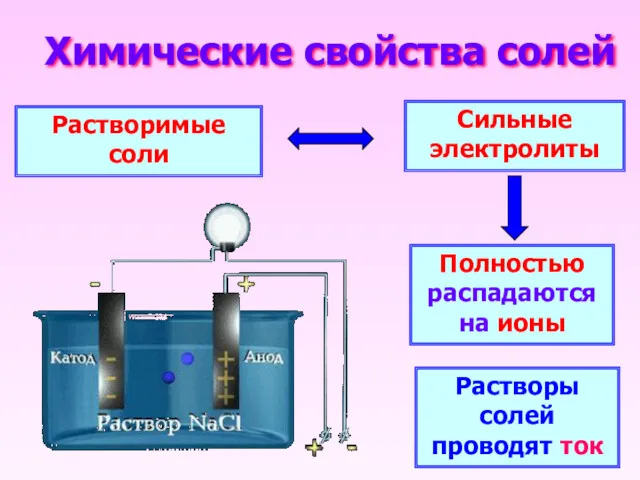
- 4. Химические свойства солей Растворимые соли Сильные электролиты Полностью распадаются на ионы Растворы солей проводят ток
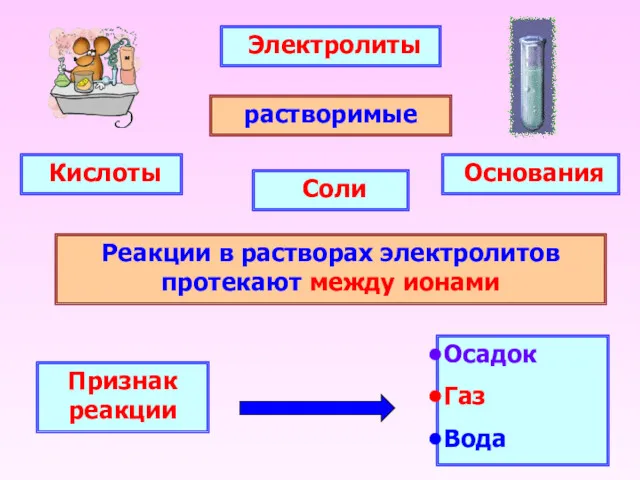
- 5. Электролиты растворимые Основания Соли Кислоты Реакции в растворах электролитов протекают между ионами Признак реакции Осадок Газ
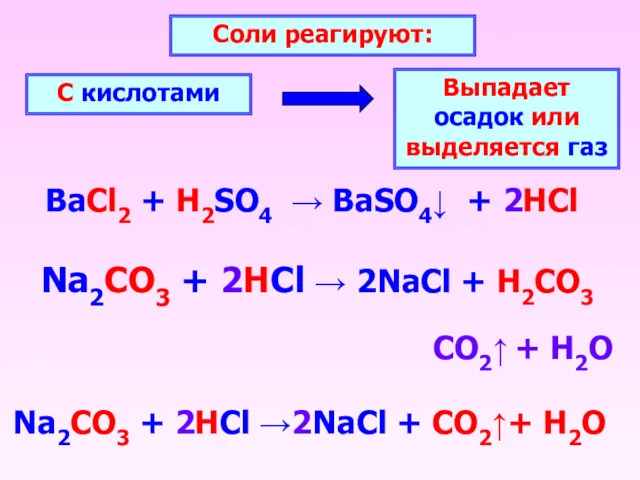
- 6. BaCl2 + H2SO4 → BaSO4↓ + 2HCl Соли реагируют: С кислотами Выпадает осадок или выделяется газ
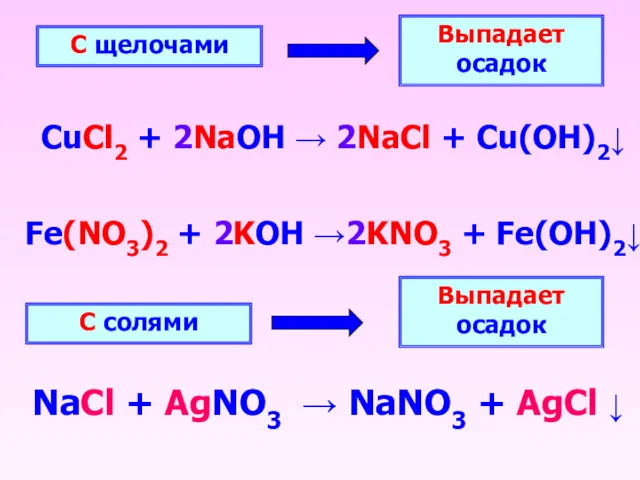
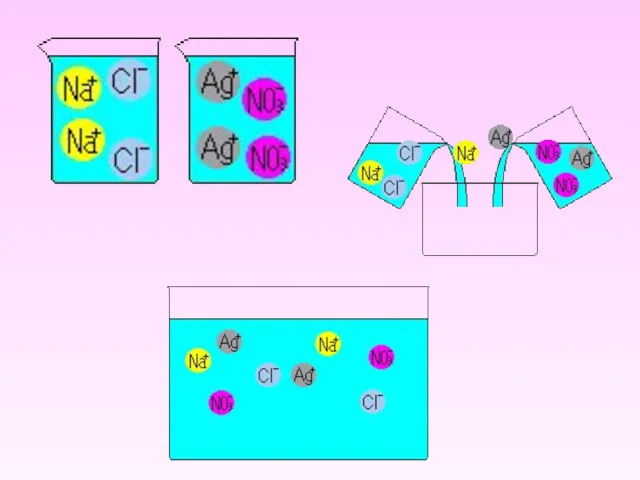
- 7. С щелочами Выпадает осадок CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓ С солями Выпадает осадок NaCl
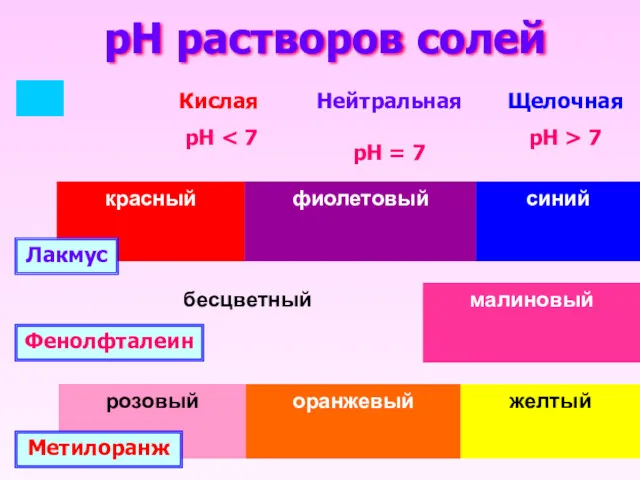
- 9. pH растворов солей Лакмус Фенолфталеин Метилоранж Кислая рН Нейтральная рН = 7 Щелочная рН > 7
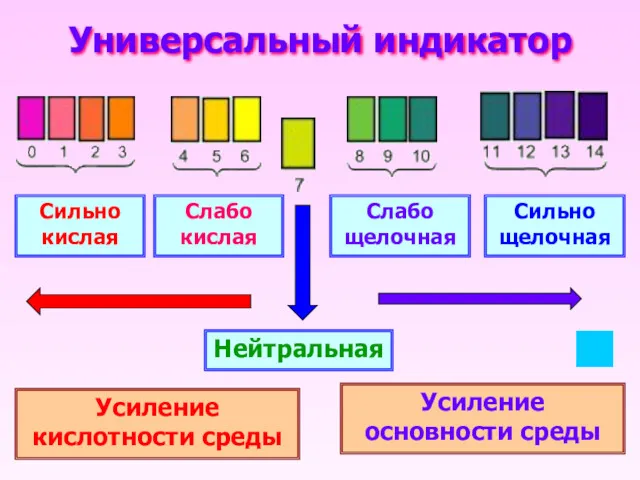
- 10. Универсальный индикатор Сильно кислая Слабо кислая Слабо щелочная Сильно щелочная Нейтральная Усиление кислотности среды Усиление основности
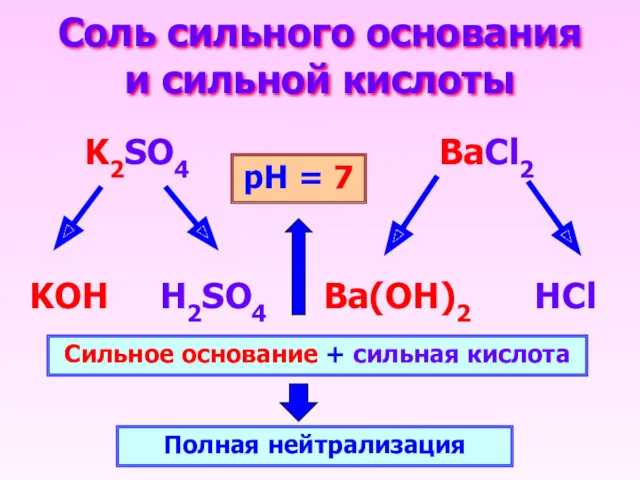
- 12. Соль сильного основания и сильной кислоты K2SO4 BaCl2 KOH H2SO4 HCl Ba(OH)2 Сильное основание + сильная
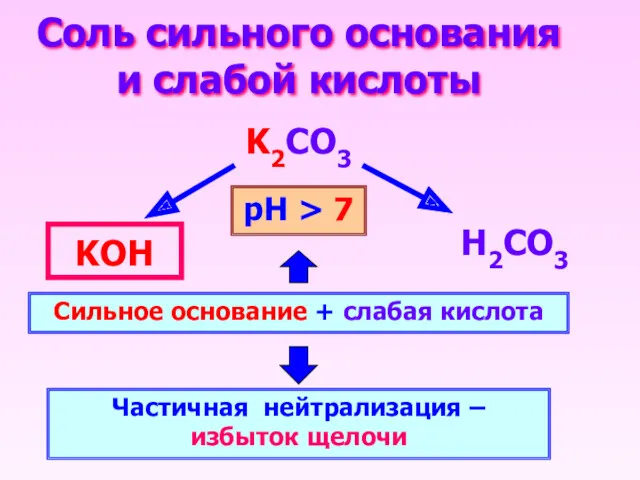
- 13. Соль сильного основания и слабой кислоты K2CO3 Н2CO3 KОН Сильное основание + слабая кислота Частичная нейтрализация
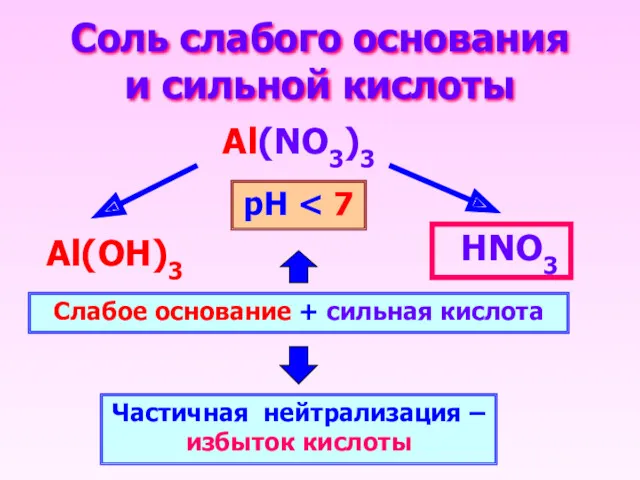
- 14. Соль слабого основания и сильной кислоты Al(NO3)3 НNO3 Al(OН)3 Слабое основание + сильная кислота Частичная нейтрализация
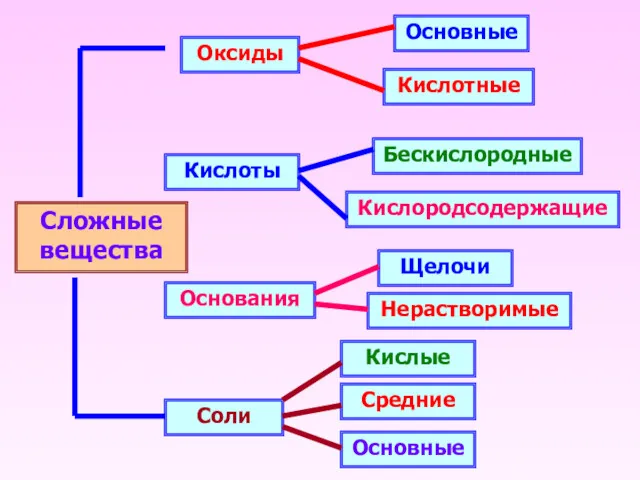
- 15. Сложные вещества Оксиды Кислоты Основания Соли Основные Кислотные Кислородсодержащие Бескислородные Щелочи Нерастворимые Основные Средние Кислые
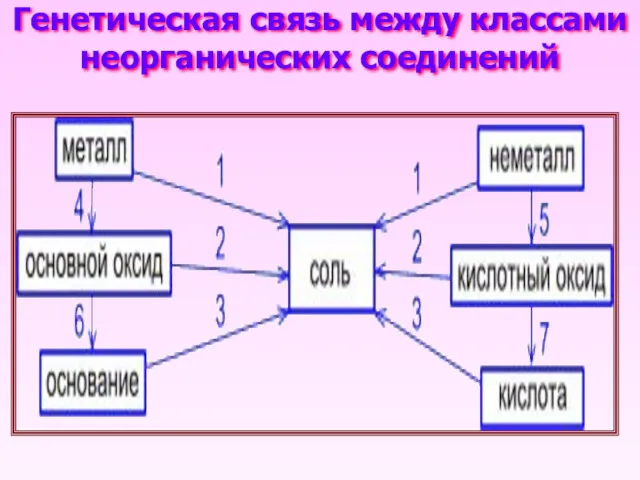
- 16. Генетическая связь между классами неорганических соединений
- 17. Примеры 1. Металл + неметалл → соль Hg + S → HgS 2Al + 3I2 →
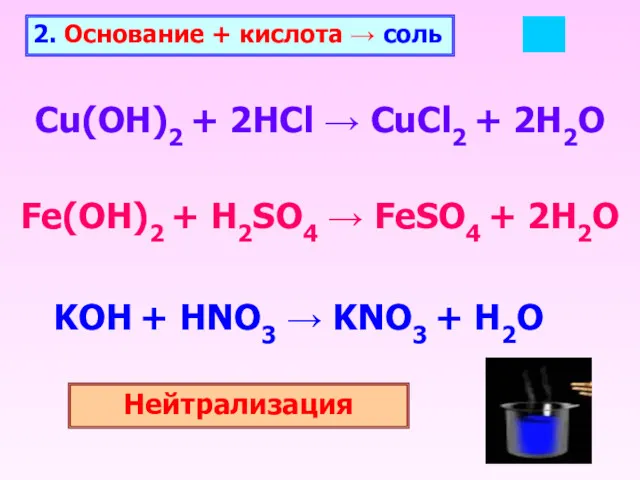
- 18. 2. Основание + кислота → соль Cu(OH)2 + 2HCl → CuCl2 + 2H2O Fe(OH)2 + H2SO4
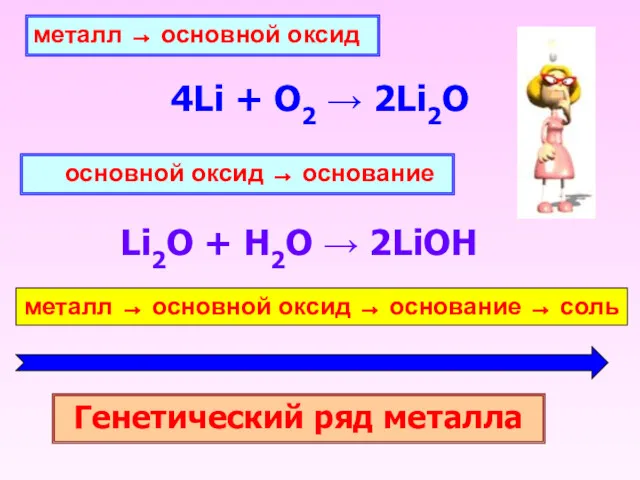
- 19. металл → основной оксид 4Li + O2 → 2Li2O основной оксид → основание Li2O + H2O
- 21. Скачать презентацию


 Элемент V группы фосфор
Элемент V группы фосфор Первичная переработка нефти
Первичная переработка нефти Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Железо
Железо Основные классы неорганических соединений
Основные классы неорганических соединений Нуклеопротеины
Нуклеопротеины Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Реакции ионного обмена
Реакции ионного обмена Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Алкалоиды, производные тропана
Алкалоиды, производные тропана Титриметрический метод анализа
Титриметрический метод анализа Figure
Figure Урок 25
Урок 25 Лекция 8.3. Реакции окисления и восстановления органических соединений
Лекция 8.3. Реакции окисления и восстановления органических соединений Халькогены. Кислород
Халькогены. Кислород Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Кристаллические решетки
Кристаллические решетки Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химическая связь
Химическая связь Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Методика изучения современной теории строения как фундамента курса органической химии в старшей школе
Методика изучения современной теории строения как фундамента курса органической химии в старшей школе Производные пиримидина
Производные пиримидина Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов