Слайд 2

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
Ограниченно растворимыми называют
жидкости, которые в пределах определенных концентраций и температур образуют одну гомогенную фазу; в другой области концентраций и температур система становится гетерогенной.
Изучение взаимной растворимости проводят с помощью диаграмм состояния в координатах температура - состав при р — const. Кривая на диаграмме называется кривой расслоения. Такие диаграммы позволяют определить составы жидких лекарственных форм, не расслаивающиеся при хранении.
Слайд 3

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
Температура, выше которой
происходит неограниченное растворение двух жидкостей, называется верхней критической точкой растворения, а температура, ниже которой происходит неограниченное растворение двух жидкостей, называется нижней критической точкой растворения.
По характеру зависимости взаимной растворимости от температуры жидкости делят на четыре типа:
Слайд 4

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
а) с верхней критической
температурой растворения. Примером является вода/фенол; анилин/вода и др.
Прибавляя анилин к воде небольшими порциями можно наблюдать, что до определенного состава система остается прозрачной - образуется однородный ненасыщенный раствор анилина в воде. Дальнейшее добавление анилина вызывает помутнение системы, а при отстаивании - появление нового слоя -насыщенного раствора воды в анилине. Система становится гетерогенной, жидкости более не растворяются друг в друге.
Слайд 5

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
Вначале количество вновь образовавшегося
слоя незначительно, но по мере добавления новых порций анилина оно растет, одновременно уменьшается количество водного слоя. Наконец, слой, представляющий собой насыщенный раствор анилина в воде, исчезает. Остается раствор воды в анилине. С этого момента снова наблюдается неограниченная взаимная растворимость жидкостей.
Слайд 6

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
С увеличением температуры
взаимная растворимость компонентов растет и область гетерогенного состояния уменьшается. Температуру, чуть выше которой наступает неограниченная взаимная растворимость компонентов, называют верхней критической температурой растворения. Температуру, соответствующую появлению (или исчезновению) второй фазы, называют температурой гетерогенизации (или гомогенизации) раствора данного состава.
Слайд 7

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
б) с нижней критической
температурой растворения. Примером
являются система - триэтиламин/вода. У жидкостей данного типа взаимная
растворимость компонентов растет с уменьшением температуры и чуть
ниже критической температуры растворения наступает неограниченная
растворимость.
Слайд 8

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
в) с верхней и нижней
критическими температурами растворения.
Примером является система - никотин/вода. У жидкостей этого типа наименьшая взаимная растворимость при температуре, затем растворимость растет и при увеличении, и при уменьшении температуры. Для них характерны две критические температуры растворения. Выше и ниже наступает неограниченная растворимость компонентов друг в друге.
Слайд 9

1. Фазовые диаграммы частично смешивающихся жидкостей, их анализ
г) без критических температур растворения.
Примером жидкостей данного типа может быть смесь этилового эфира с водой. При температуре -
3,8°С насыщенный раствор эфира в воде замерзает и ниже этой температуры существует раствор, содержащий 1% воды в эфире. При температуре 20°С эфирный слой содержит 2% воды. Выше этой температуры эфир испаряется и может существовать только водный раствор эфира. Таким образом, критические температуры смешения достичь не удается.
Слайд 10

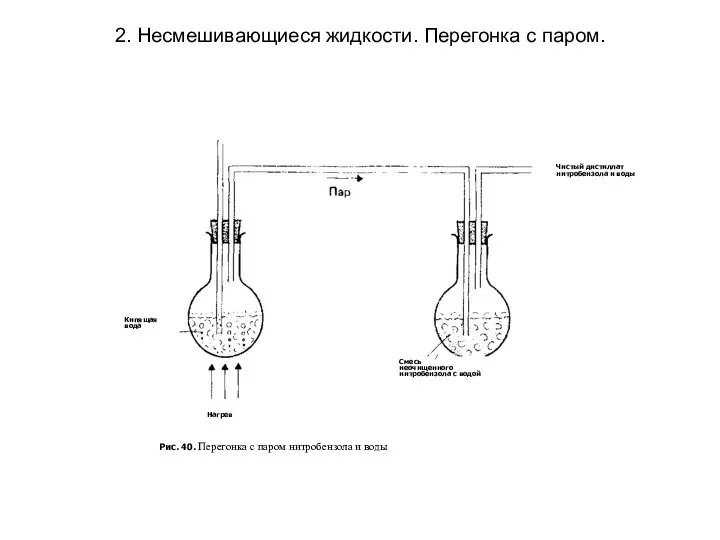
2. Несмешивающиеся жидкости. Перегонка с паром.
Если обе жидкости нерастворимы одна
в другой, то при их смешивании в любых пропорциях образуются два отдельных слоя. Такие жидкости называются несмешивающимися (например хлорбензол - вода, нитробензол - вода ). Поскольку полное давление пара в системе из двух несмешивающихся жидкостей больше давления пара каждого из ее компонентов, температура, при которой кипит смесь, ниже температуры кипения каждого из ее компонентов. На этом основана перегонка с паром. При давлении 1 атм вода имеет температуру кипения 100°С.
Слайд 11
2. Несмешивающиеся жидкости. Перегонка с паром.
Слайд 12

2. Несмешивающиеся жидкости. Перегонка с паром.
Перегонку с паром используют в
следующих целях:
для очистки таких жидкостей, как нитробензол или фениламин, которые имеют высокую температуру кипения. Перегонка при более низкой температуре устраняет риск термического разложения жидкости. В настоящее время с этой целью вместо перегонки с паром предпочитают использовать вакуумную перегонку;
Слайд 13

2. Несмешивающиеся жидкости. Перегонка с паром.
для экстрагирования растительных масел, например в
фармацевтической промышленности.
для вычисления молярной массы с помощью перегонки с паром. Молярную массу жидкости, не смешивающейся с водой, можно вычислить на основании данных, полученных в результате ее перегонки с паром.












 Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Карбонильные соединения. Альдегиды и кетоны
Карбонильные соединения. Альдегиды и кетоны Гидролиз солей
Гидролиз солей Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару
Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару Химические реакции органических соединений
Химические реакции органических соединений Фосфор
Фосфор Неметаллы. Элементы V группы
Неметаллы. Элементы V группы Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Соли. Свойства солей
Соли. Свойства солей Назначение установки Пенекс
Назначение установки Пенекс Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь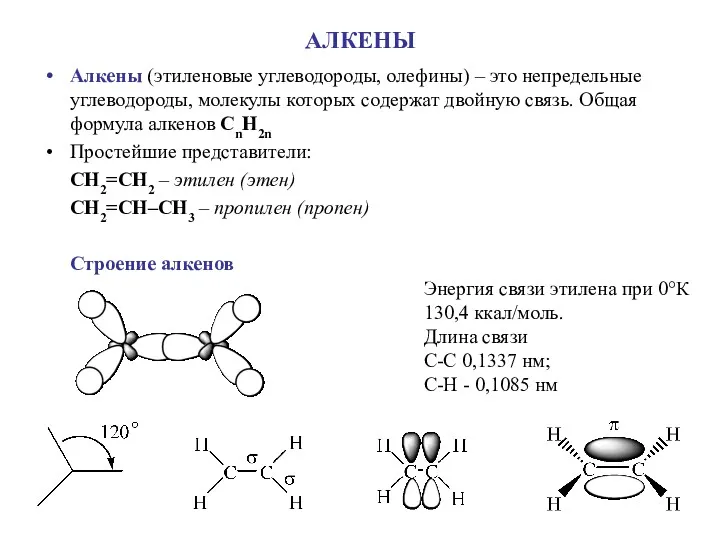 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Железо и его свойства
Железо и его свойства Чисті речовини та суміші. (7 клас)
Чисті речовини та суміші. (7 клас) Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Зерттеу әдістері
Зерттеу әдістері Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор
Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор Главная подгруппа II группы
Главная подгруппа II группы драгоценные и поделочные
драгоценные и поделочные Химия титанорганических соединений
Химия титанорганических соединений Медициналық тәжірибедегі потенциометриялар
Медициналық тәжірибедегі потенциометриялар Кислотно-основное титрование
Кислотно-основное титрование Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Спирты: классификация, изомерия, номенклатура
Спирты: классификация, изомерия, номенклатура