Содержание
- 2. в органической химии большое внимание уделяется изучению механизмов реакций общее число органических реакций очень велико, число
- 3. химическая реакция; скорость химической реакции; энергия активации; тепловой эффект реакции; химическое равновесие; катализ. Основные понятия общей
- 4. Химическая реакция – процесс превращения веществ, сопровождающийся изменением их состава и (или) строения. Происходит разрыв химических
- 5. Химическая реакция записывается в виде уравнения: Химическая реакция
- 6. В уравнениях реакций с участием органических соединений (органических реакциях) знак равенства заменяется стрелкой : Химическая реакция
- 7. скорость изменения количества (молярной концентрации) одного из реагирующих веществ. Скорость реакции определяется изменением количества вещества в
- 8. c1 и c2-молярные концентрации вещества в моменты времени t1 и t2, соответственно; знак “+” ставится, если
- 9. Отношение Δc /Δt определяет скорость за какой-то промежуток времени и называется средней скоростью. Чем меньше интервал
- 10. Факторы, влияющие на скорость химической реакции концентрация реагирующих веществ (закон действующих масс); Температура (правило Вант-Гоффа; давление
- 11. Энергия активации энергия, необходимая для достижения системой переходного состояния, называемого активированным (или переходным) комплексом, который превращается
- 12. Энергия активации Энергия активации Еа равна разности энергий переходного и исходного состояний: Еа = Еперех.сост. -
- 13. Энергия активации Чем меньше энергия активации реакции, тем выше ее скорость. Эта зависимость выражается уравнением Аррениуса,
- 14. Константа скорости реакции удельная скорость реакции - является коэффициентом пропорциональности в кинетическом уравнении. k численно равна
- 15. Тепловой эффект реакции количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
- 16. Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q>0, ΔH Реакции, которые идут с поглощением
- 17. Химическое равновесие Обратимая реакция - химическая реакция, которая при одних и тех же условиях может идти
- 18. Химическое равновесие Необратимой называется реакция, которая идет практически до конца в одном направлении:
- 19. Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
- 20. Принцип Ле-Шателье - внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия
- 21. Принцип Ле-Шателье Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема. Повышение температуры смещает
- 22. Катализ Катализ - изменение скорости химической реакции в присутствии веществ, которые, участвуя в реакции, к моменту
- 23. Катализ Катализ называется положительным, если скорость реакции увеличивается, и отрицательным, если скорость уменьшается. при гомогенном катализе
- 24. Механизм действия катализатора связан с тем, что они снижают энергию активации реакции за счет образования промежуточных
- 25. Отличительные особенности органических реакций 1. В реакциях органических соединений, как правило, изменения затрагивают только часть молекулы
- 26. Отличительные особенности органических реакций 2. Большинство органических реакций протекают значительно медленнее реакций неорганических веществ и обычно
- 27. Отличительные особенности органических реакций Последовательность принято изображать в виде схемы превращений, в которой реагент записывается над
- 28. Механизм реакций Механизм реакции - описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия
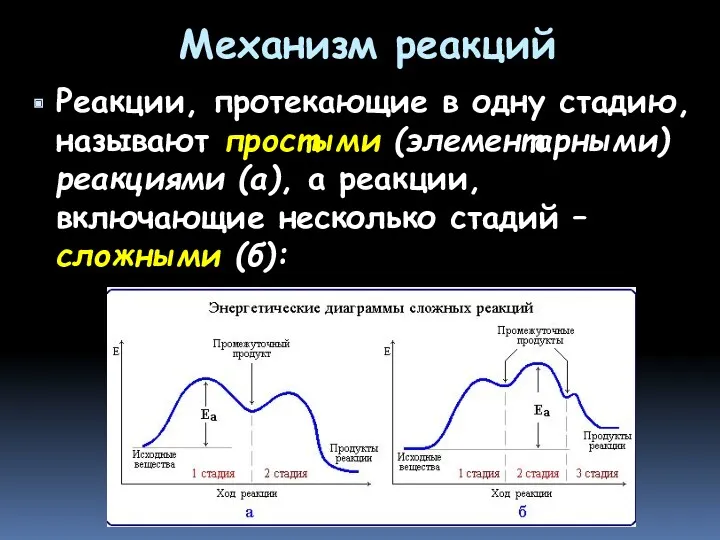
- 29. Механизм реакций Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями (а), а реакции, включающие несколько
- 30. Классификация органических реакций по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов); по
- 31. Классификация реакций по конечному результату: разложения; соединения; замещения; перегруппировки (изомеризация)
- 32. Реакции разложения В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или
- 33. Реакции разложения реакции крекинга - расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов
- 34. Реакции разложения реакции отщепления (элиминирования) - отрыв от молекулы исходного органического соединения отдельных атомных групп при
- 35. Реакции присоединения Молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при
- 36. Реакции замещения Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную
- 37. Реакции изомеризации или перегруппировки В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от
- 38. Реакции изомеризации или перегруппировки в результате перегруппировки может изменяться углеродный скелет молекулы:
- 39. Реакции окисления Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель
- 40. Реакции востановления Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают
- 41. Степень окисления Степень окисления углерода в его соединениях изменяется в диапазоне от -4 (например, в метане
- 42. Степень окисления Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи
- 43. Классификация реакций по числу частиц, участвующих в элементарной стадии По этому признаку все реакции можно разделить
- 44. Мономолекулярные реакции реакции, в которых участвует только одна молекула (частица): А —> В + . .
- 45. Бимолекулярные реакции реакции типа: А + В —> С + . . . , в которых
- 46. Тримолекулярные реакции реакции типа: 2А + В —> С + . . . , в которых
- 47. Классификация реакций по механизму разрыва связей В зависимости от способа разрыва ковалентной связи в реагирующей молекуле
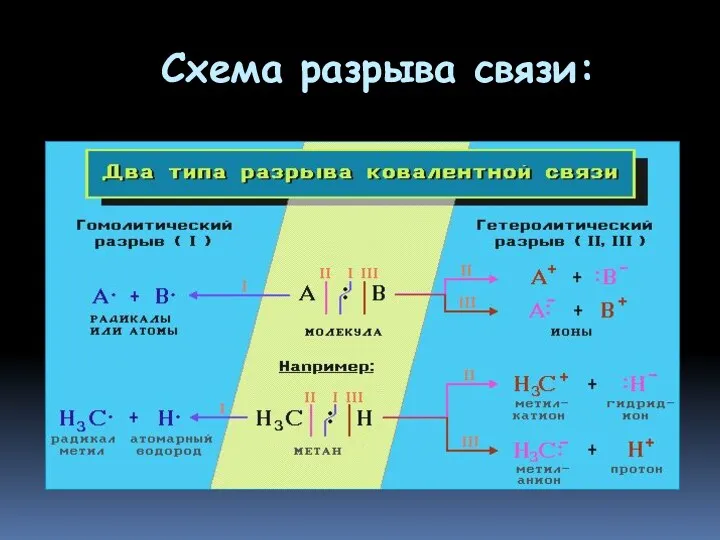
- 48. Разрыв ковалентной связи 1.Разрыв связи, при котором каждый атом получает по одному электрону из общей пары,
- 49. Разрыв ковалентной связи Если при разрыве связи общая электронная пара остается у одного атома, то такой
- 50. Схема разрыва связи:
- 51. Радикальные реакции Реакции, в которых происходит гомолитический разрыв связей и образуются свободно-радикальные промежуточные частицы, называются радикальными
- 52. Стадии процесса: Cl2 —> 2 Cl· (на свету) Cl· + H–CH3 —> HCl + ·CH3 ·CH3
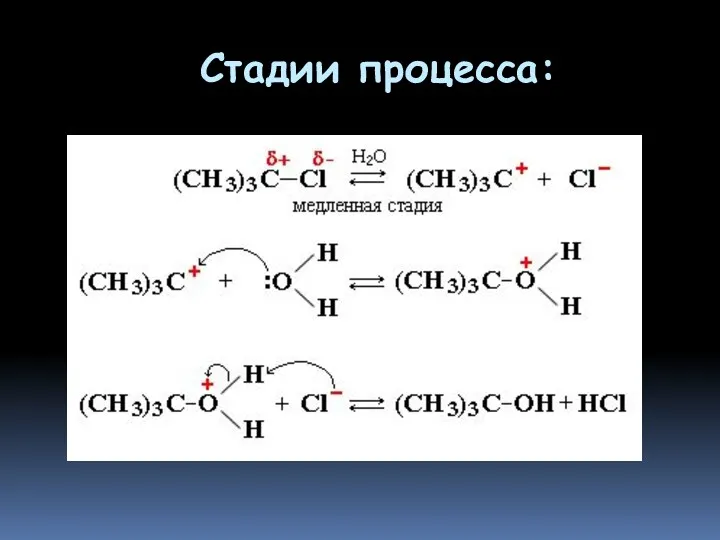
- 53. Ионные реакции Реакции, в которых происходит гетеролитический разрыв связей и образуются промежуточные частицы ионного типа, называются
- 54. Стадии процесса:
- 55. Контрольные вопросы Укажите тип реакции: Ответ 1: замещения Ответ 2: присоединения Ответ 3: элиминирования Ответ 4:
- 56. Контрольные вопросы 2. Какие типы реакций представлены в схеме превращений: Ответ 1 : I - присоединение;
- 57. Контрольные вопросы 3. Реакциями замещения в схеме являются:
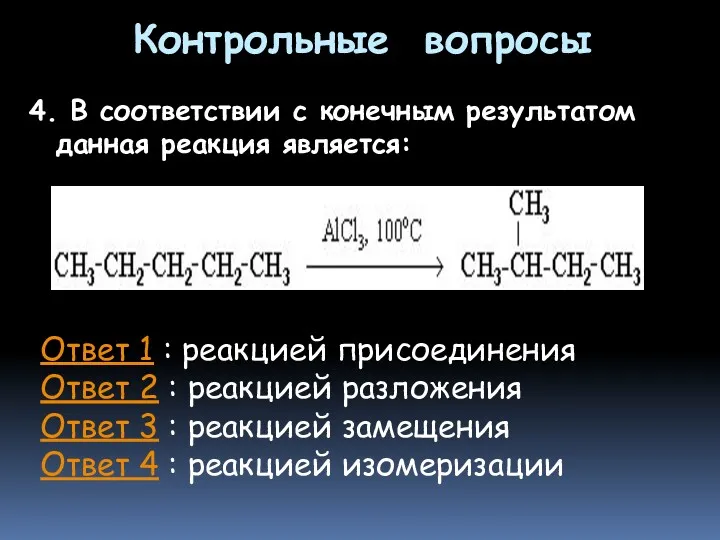
- 58. Контрольные вопросы 4. В соответствии с конечным результатом данная реакция является: Ответ 1 : реакцией присоединения
- 59. Контрольные вопросы 5. Как изменяется степень окисления атома углерода при горении метана: CH4 + 2O2 —>
- 61. Скачать презентацию






















































 Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Химия и здоровье человека
Химия и здоровье человека Относительная молекулярная масса
Относительная молекулярная масса Оксиды серы. Сернистая кислота
Оксиды серы. Сернистая кислота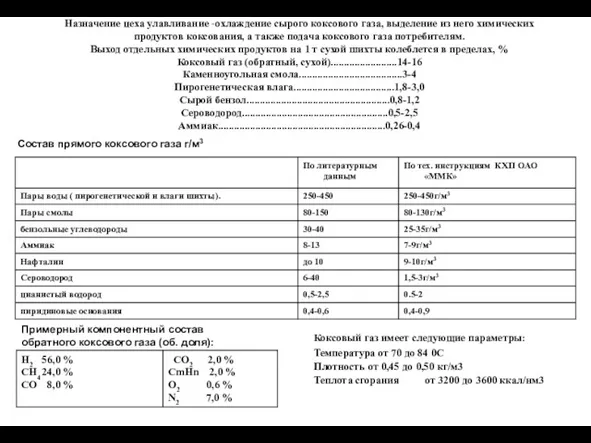 Охлаждение сырого коксового газа, выделение из него химических продуктов коксования
Охлаждение сырого коксового газа, выделение из него химических продуктов коксования Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Оксид углерода-С
Оксид углерода-С Биохимические аспекты биотрансформации лекарственных веществ
Биохимические аспекты биотрансформации лекарственных веществ Агрегатные состояния вещества
Агрегатные состояния вещества Sm-Nd метод
Sm-Nd метод Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Розв’язування експериментальних задач (9 клас)
Розв’язування експериментальних задач (9 клас) Неизотермический процесс в химическом реакторе. Лекция 8
Неизотермический процесс в химическом реакторе. Лекция 8 Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар Кремний и его соединения. 9 класс
Кремний и его соединения. 9 класс Химические добавки к бетонам
Химические добавки к бетонам Вуглеводи
Вуглеводи 20230306_znachenie_periodicheskogo_zakona_d._i._mendeleeva
20230306_znachenie_periodicheskogo_zakona_d._i._mendeleeva Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Физико-химия дисперсных систем в функционировании живых систем
Физико-химия дисперсных систем в функционировании живых систем Основания
Основания 20230419_soli
20230419_soli Багатоатомні насичені спирти. Фізичні та хімічні властивості
Багатоатомні насичені спирти. Фізичні та хімічні властивості Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Химическая связь
Химическая связь Круговорот углерода в природе
Круговорот углерода в природе Физические и химические свойства аренов
Физические и химические свойства аренов