Слайд 2

Сравнительная характеристика SO2 и SO3
Слайд 3

Слайд 4

Слайд 5

Сернистая кислота
H2SO3 − очень неустойчивая двухосновная кислота. Легко распадается на диоксид
серы и воду.
1. H2SO3 ↔ HSO3– + H+
2. HSO3– ↔ SO32– + H+
Проявляет окислительно- восстановительную двойственность (наиболее ярко выражены восстановительные!)
H2SO3 + Br2 + H2O → H2SO4 + HBr (Сделать электронный баланс)
H2SO3 + HNO3 → H2SO4 + NO2 + H2O(Сделать электронный баланс)
H2SO3 + Н2S → S + H2O (Сделать электронный баланс)
H2SO3 + KMnO4 → H2SO4 + MnSO4 +K2SO4 + H2O (Сделать электронный баланс)
Слайд 6

Сульфиты
Соли сернистой кислоты− сульфиты
2Na2SO3 + O2 → 2Na2SO4
Na2SO3 + Вr2 + Н2O →
Na2SO4 + 2НВr
Na2SO3 + ЗС → Na2S + ЗСО
Качественная реакция на ион SO32-
Na2SO3 + 2HCl = 2NaCl + SO2↑ + Н2O
Слайд 7

Применение
Оксид серы (IV) используется для:
производства серной кислоты
качестве консерванта (пищевая добавка
Е220)
т.к. он убивает микроорганизмы, им окуривают овощехранилища и склады
для отбеливания соломы, шелка и шерсти
в качестве растворителя в лабораториях.
Сульфит и гидросульфит натрия используются к качестве отбеливателя текстиля и бумаги , а так же в фотографии






 Химические свойства алкенов
Химические свойства алкенов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Классификация органических соединений
Классификация органических соединений Классы неорганических соединений. 8 класс
Классы неорганических соединений. 8 класс Знаки вторичной переработки
Знаки вторичной переработки Застосуванння електролiзу
Застосуванння електролiзу Магматические формации
Магматические формации Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Химическая связь в кластерах
Химическая связь в кластерах Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Структура стекла
Структура стекла Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Фосфор и его основные соединения
Фосфор и его основные соединения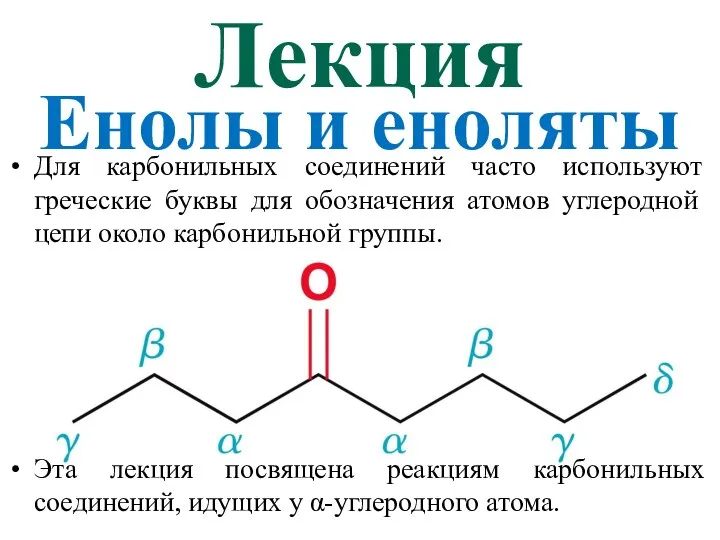 Енолы и еноляты
Енолы и еноляты Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Белки. 9 класс
Белки. 9 класс Коррозия и защита строительных материалов
Коррозия и защита строительных материалов ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Ізомери у природі
Ізомери у природі Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна