Содержание
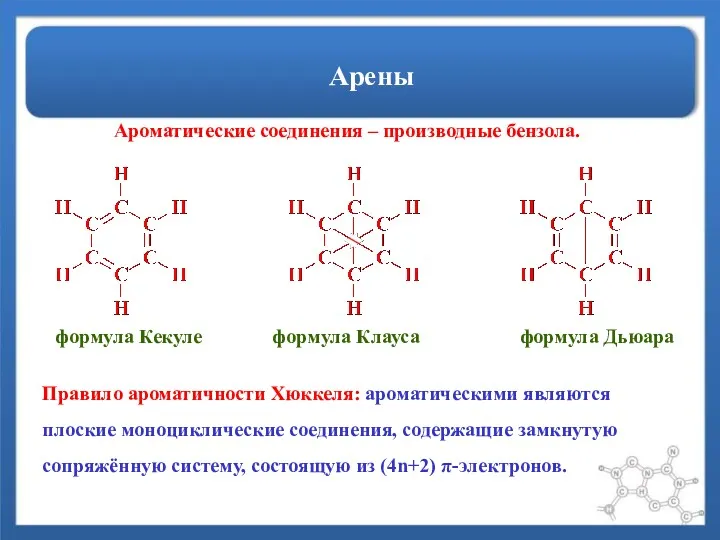
- 2. Арены Ароматические соединения – производные бензола. формула Кекуле формула Клауса формула Дьюара Правило ароматичности Хюккеля: ароматическими
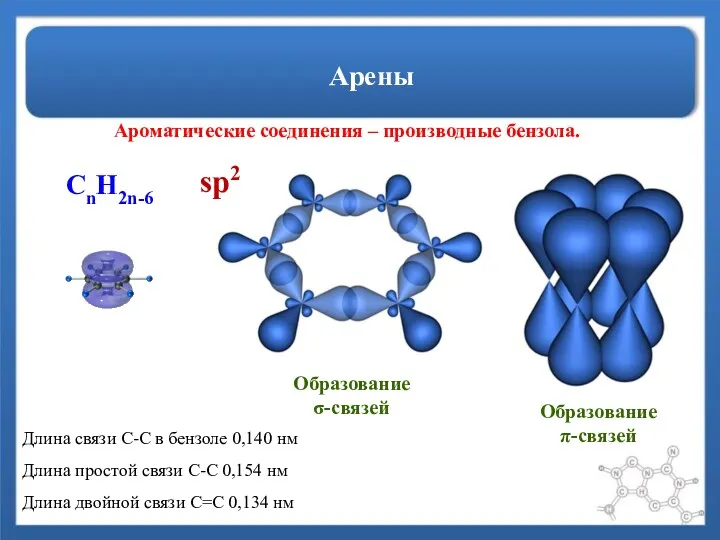
- 3. Арены Ароматические соединения – производные бензола. Образование σ-связей Образование π-связей sp2 CnH2n-6 Длина связи С-С в
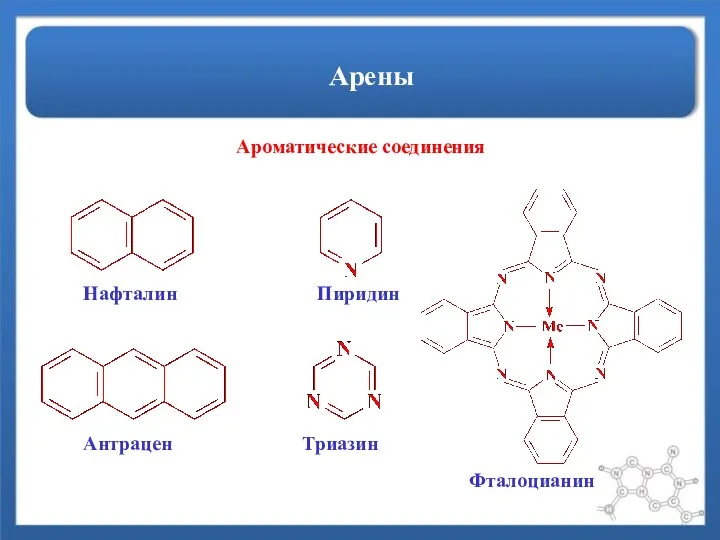
- 4. Арены Ароматические соединения Нафталин Пиридин Антрацен Триазин Фталоцианин
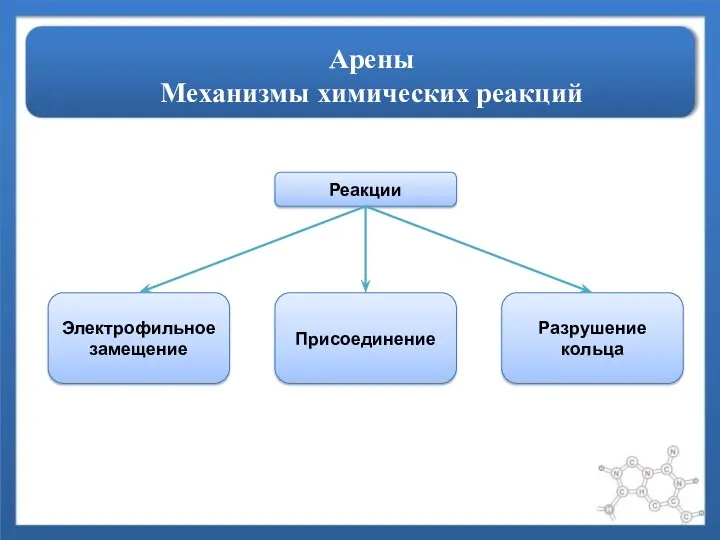
- 5. Арены Механизмы химических реакций Реакции Электрофильное замещение Присоединение Разрушение кольца
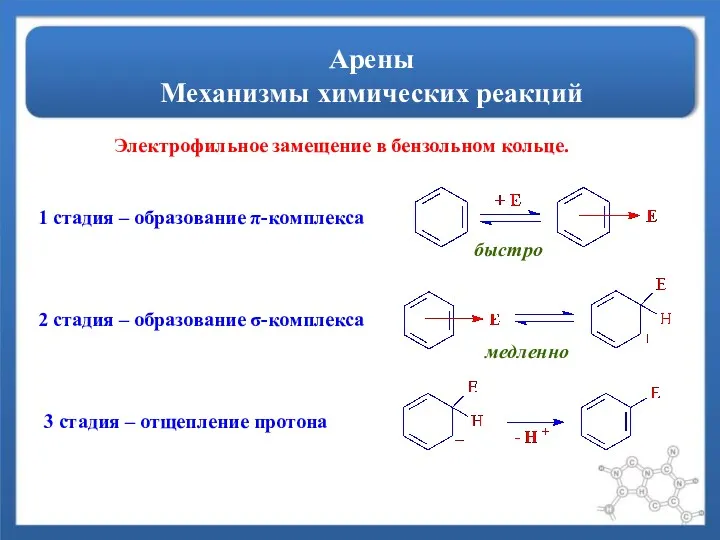
- 6. Арены Механизмы химических реакций Электрофильное замещение в бензольном кольце. 1 стадия – образование π-комплекса быстро 2
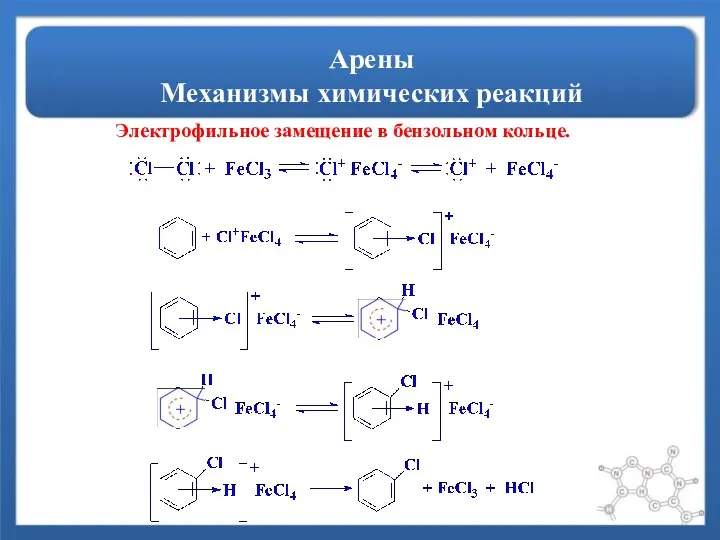
- 7. Арены Механизмы химических реакций Электрофильное замещение в бензольном кольце.
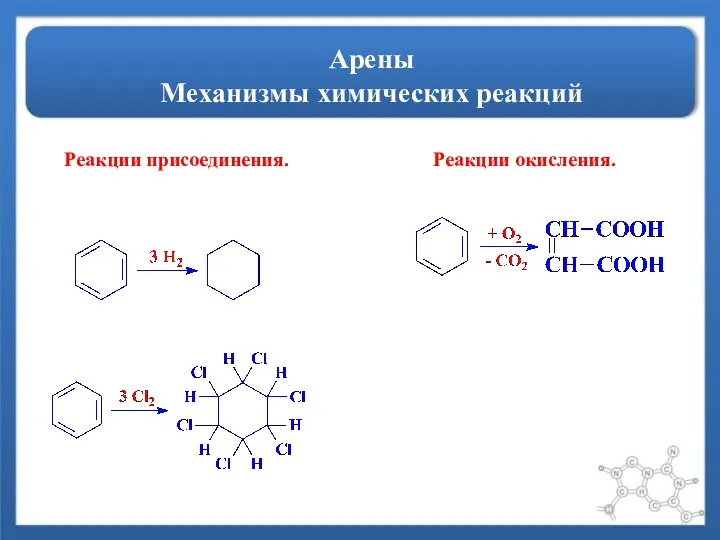
- 8. Арены Механизмы химических реакций Реакции присоединения. Реакции окисления.
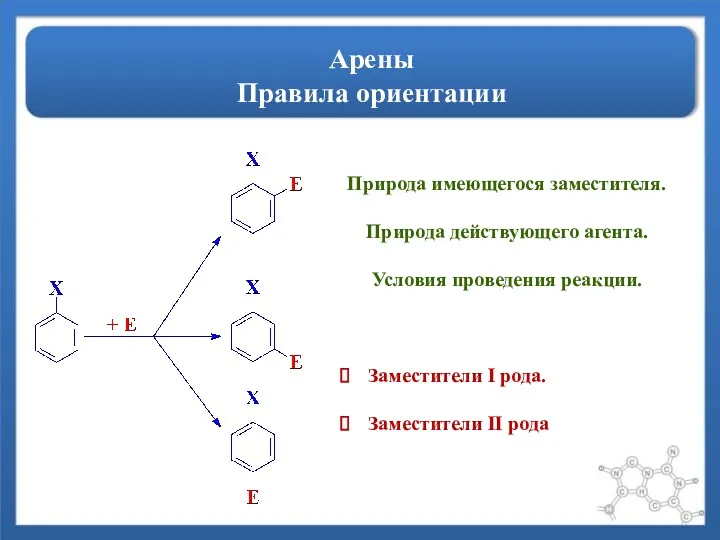
- 9. Арены Правила ориентации Правила ориентации – закономерности, определяющие направление реакций замещения в бензольном кольце. Активирующая группа
- 10. Арены Правила ориентации Природа имеющегося заместителя. Природа действующего агента. Условия проведения реакции. Заместители I рода. Заместители
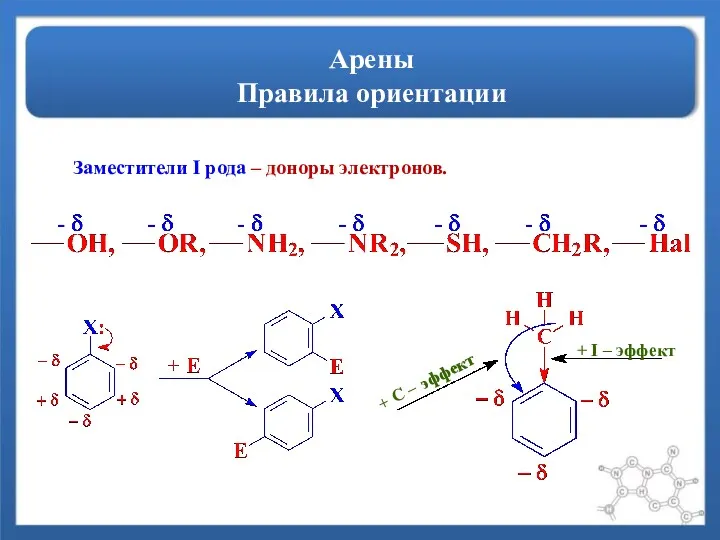
- 11. Арены Правила ориентации Заместители I рода – доноры электронов. + С – эффект + I –
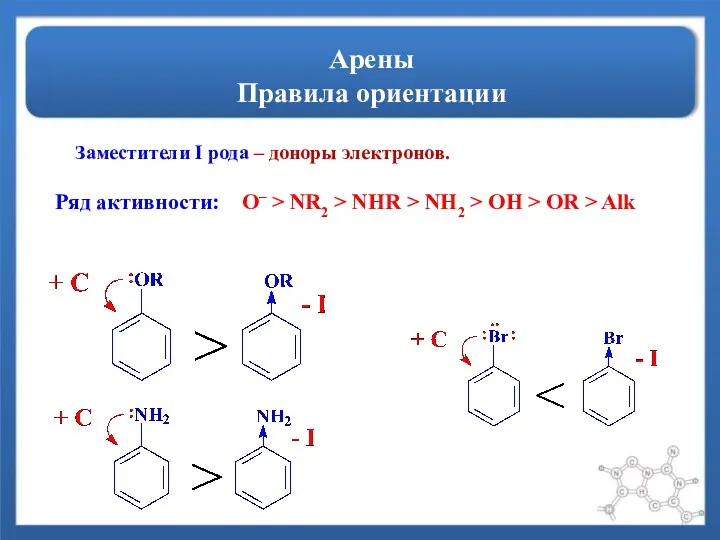
- 12. Арены Правила ориентации Заместители I рода – доноры электронов. Ряд активности: O– > NR2 > NHR
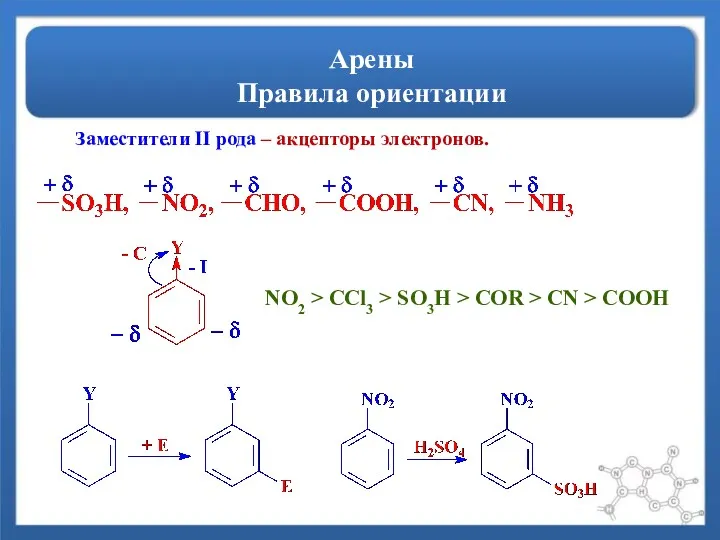
- 13. Арены Правила ориентации Заместители II рода – акцепторы электронов. NO2 > CCl3 > SO3H > COR
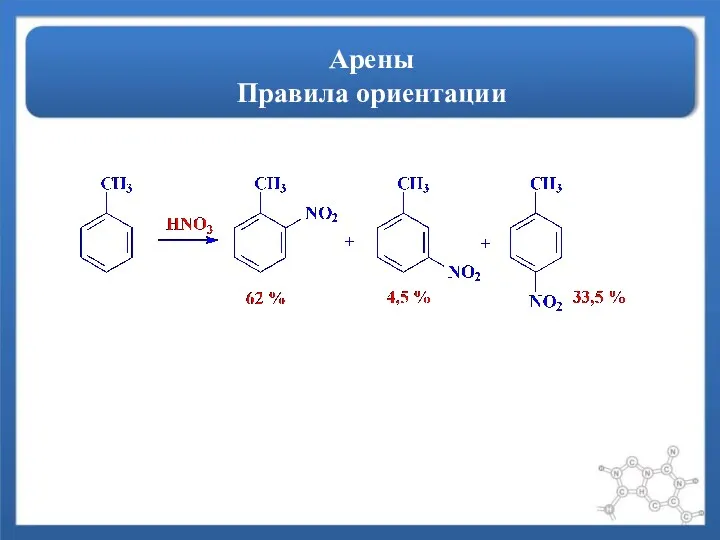
- 14. Арены Правила ориентации
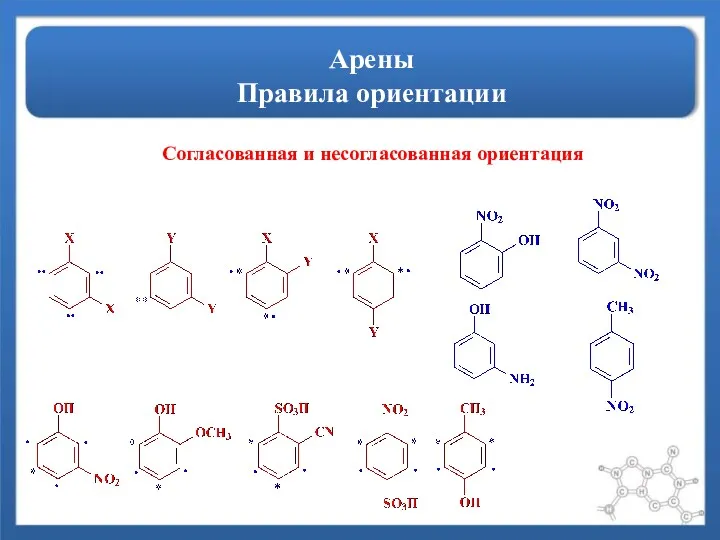
- 15. Арены Правила ориентации Согласованная и несогласованная ориентация
- 16. Арены Правила ориентации ВАЖНО!!! Все заместители первого рода являются более сильными ориентантами, чем заместители второго рода.
- 18. Скачать презентацию


 Свойства смесей ПАВ
Свойства смесей ПАВ Строение вещества. Химическая связь
Строение вещества. Химическая связь Химическая термодинамика
Химическая термодинамика Минеральные удобрения. Для школьников
Минеральные удобрения. Для школьников Значення хімічних процесів у природі
Значення хімічних процесів у природі Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Системи удобрення сільськогосподарських культур
Системи удобрення сільськогосподарських культур Закон сохранения массы вещества
Закон сохранения массы вещества Кристаллы, их свойства, получение, применение в природе и жизни человека
Кристаллы, их свойства, получение, применение в природе и жизни человека Кислород. 9 класс
Кислород. 9 класс Классы неорганических веществ
Классы неорганических веществ Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Молекулярно-массовые характеристики высокомолекулярных соединений
Молекулярно-массовые характеристики высокомолекулярных соединений Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Готовимся к экзамену по химии
Готовимся к экзамену по химии Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы Азотная кислота
Азотная кислота Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Реакции терпеноидов. Тема № 4
Реакции терпеноидов. Тема № 4 Менделеевские уроки. День науки
Менделеевские уроки. День науки Валентность и степень окисления 8 класс
Валентность и степень окисления 8 класс Лаборатория красивых волос
Лаборатория красивых волос Минерал лазурит. Месторождения
Минерал лазурит. Месторождения Поделочные камни
Поделочные камни Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары