Содержание
- 2. Основные вопросы Строение молекулы азотной кислоты. Физические свойства. Получение азотной кислоты. Химические свойства. Свойства нитратов. Применение
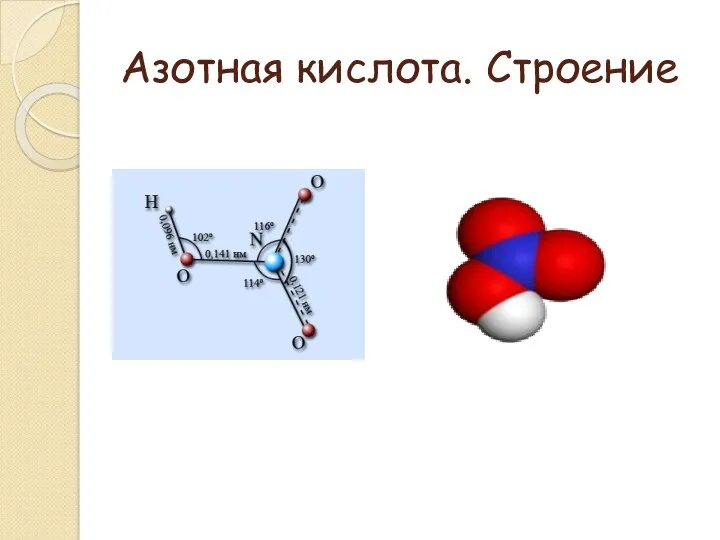
- 3. Азотная кислота. Строение
- 4. Физические свойства Дымящаяся жидкость, ρ=1,52 г/мл, беcцветная, едкий запах, Ткип=82,6ºС Тплав=-42ºС - прозрачные кристаллы, очень гигроскопична
- 5. Получение HNO3 В лаборатории (получают дымящую азотную кислоту) NaNO3(ТВ.)+H2SO4(КОНЦ)= NaHSO4 + HNO3↑ В промышлености 4NH3 +
- 6. Химические свойства Азотная кислота является сильным окислителем, концентрированная азотная кислота окисляет серу до серной, а фосфор
- 7. Свойства общие с другими кислотами Составьте уравнения реакций HNO3 + Сa(OH)2 = HNO3 + Al2O3 =
- 8. Проверьте уравнения 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O (реакция нейтрализации) 6HNO3 + Al2O3 = 2Al(NO3)3
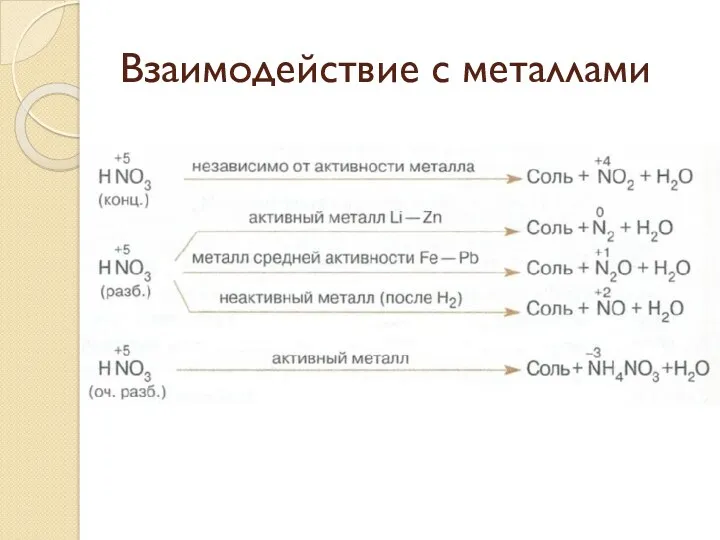
- 9. Взаимодействие с металлами
- 10. Задание: Cu + HNO3 (КОНЦ.) →
- 11. Проверь себя: Cu + 4HNO3 (КОНЦ.) → Cu(NO3)2 + 2NO2 + 2H2O
- 12. Задание: Cu + HNO3(разб.) =
- 13. Проверьте себя Cu + HNO3(разб.) = Cu(NO3)2 + NO + H2O 0 +1 Cu – 2e
- 14. Соли азотной кислоты
- 15. Нитраты щелочных металлов, кальция и аммония называют селитрами. NaNO3 – натриевая селитра (чилийская), KNO3 – калийная
- 17. Химические свойства нитратов I. Общие с другими солями 1) C металлами: Металл, стоящий в ряду активности
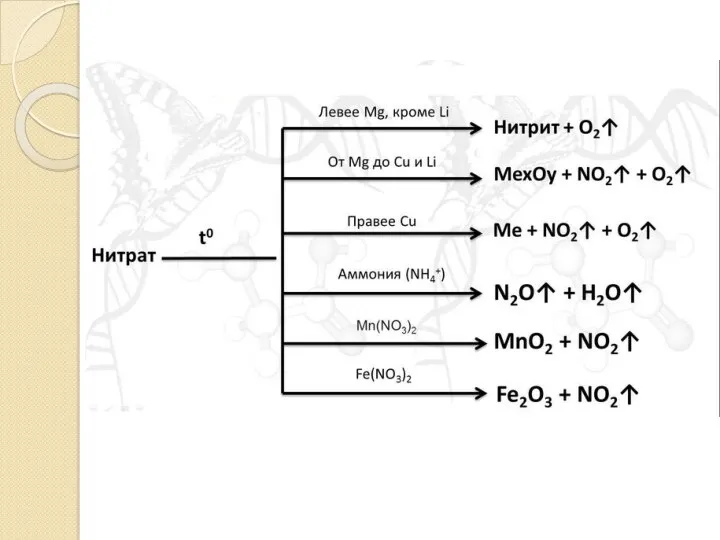
- 19. II. Специфические Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. 1) Нитраты щелочных
- 20. Подведение итогов Каковы физические свойства азотной кислоты? Почему азотную кислоту хранят в склянках из тёмного стекла?
- 22. Скачать презентацию
















 Отложения и коррозия
Отложения и коррозия Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Правила ДСС
Правила ДСС Кислоты. Общая характеристика, химические свойства
Кислоты. Общая характеристика, химические свойства Теоретические основы биоорганической химии
Теоретические основы биоорганической химии Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Углерод и его оксиды
Углерод и его оксиды Теория сплавов
Теория сплавов Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице Метангидратное ружье. Задача 3. Команда: Когнитивная машина
Метангидратное ружье. Задача 3. Команда: Когнитивная машина Спирты. Многоатомные спирты
Спирты. Многоатомные спирты Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Химические свойства кислот
Химические свойства кислот Дисперсные системы. Растворы
Дисперсные системы. Растворы Водород
Водород Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Основные способы получения металлов
Основные способы получения металлов Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли Магматические горные породы
Магматические горные породы Коллоидная химия
Коллоидная химия Классы неорганических соединений
Классы неорганических соединений Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами
Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Ізомери в природі
Ізомери в природі Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки