Содержание
- 2. Кислотами называют класс химических соединений, содержащих в своем составе подвижные атомы водорода, способные замещаться на атомы
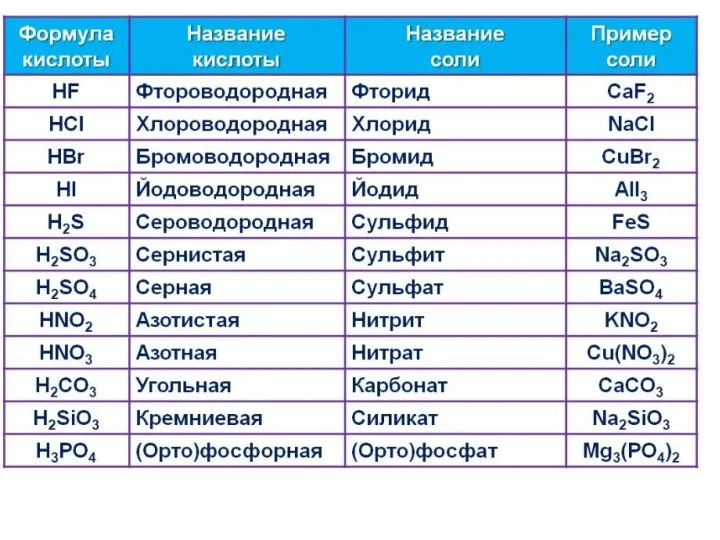
- 4. Кислоты Одноосновные (HF, HCl) Двухосновные(H2S, H2SO4) Трехосновные (H3PO4) Бескислородные (HF, HCl) Кислородные (H3PO4, H2SO4)
- 5. Сильные кислоты HI, HBr, HCl, HClO4, H2SO4, HNO3 Кислоты средней силы H2SO3, H3PO4, HF, HNO2 Слабые
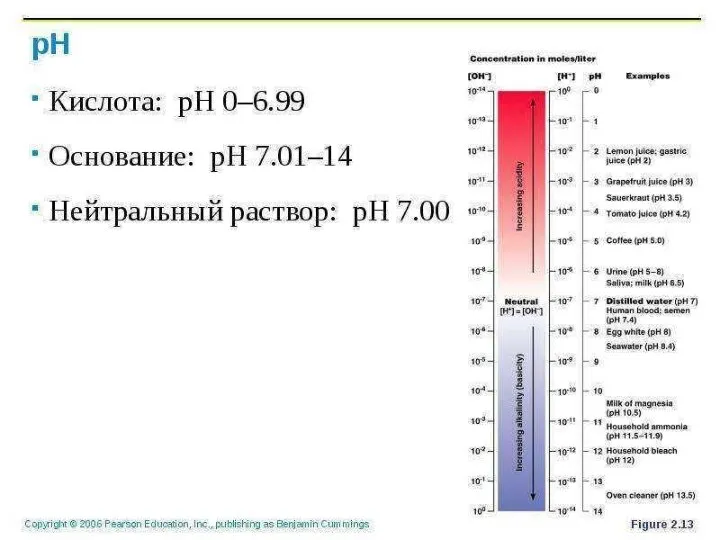
- 7. Водные растворы кислот имеют рН При этих значениях Лакмус – имеет красную окраску Метиловый оранжевый -
- 8. Кислота + металл = Кислота + основный оксид = Кислота + амфотерный оксид = Кислота +
- 9. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль 1. Кислоты
- 10. 2. C основными и амфотерными оксидами с образованием солей и воды, например: H2SO4 + MgO =
- 11. 3. Все кислоты вступают в реакцию с основаниями (реакция нейтрализации) с образованием солей и воды HCl
- 12. 4.Сильные кислоты вытесняют более слабые кислоты из их солей. При этом образуется новая кислота и новая
- 15. Скачать презентацию










 Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7
Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7 Азот. Строение атома и молекулы
Азот. Строение атома и молекулы Скорость химических реакций. Молекулярные гонки
Скорость химических реакций. Молекулярные гонки Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Кислород
Кислород Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Металлы – простые вещества
Металлы – простые вещества Предельные углеводороды ( 10 класс )
Предельные углеводороды ( 10 класс ) Пластмассы
Пластмассы Алкени та алкіни
Алкени та алкіни Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Химическая связь. Виды химической связи
Химическая связь. Виды химической связи Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Прочность полимеров
Прочность полимеров Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Бытовая химия
Бытовая химия Спирты
Спирты Подготовка к ОГЭ по химии
Подготовка к ОГЭ по химии Золото
Золото Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Аккумуляторные батареи
Аккумуляторные батареи Types of chemical bonds in crystals
Types of chemical bonds in crystals Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Основания. 8 класс
Основания. 8 класс Предмет и задачи физической химии
Предмет и задачи физической химии