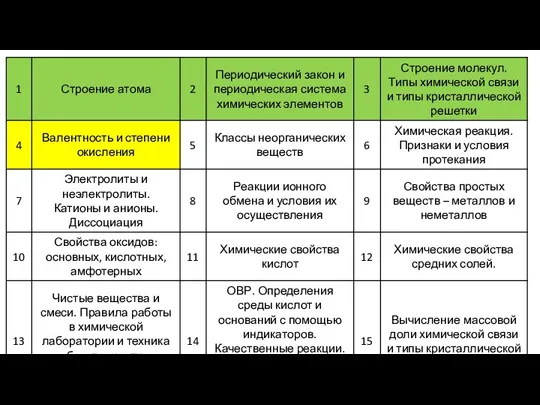
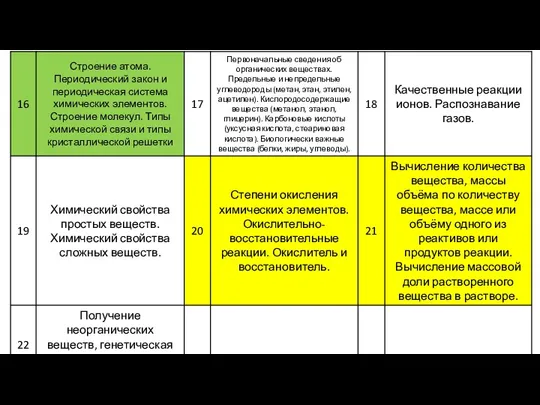
Содержание
- 2. Т.1 В какой ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ: Na, Mg, Al
- 3. Т.3 Общим для азота и фосфора является: Наличие двух энергетических уровней в их атомах Число электронов
- 4. Т.5 В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ: I, Br, Cl
- 5. Т.7 Калий и натрий отличаются: Числом электронов на внешнем энергетическом уровне их атомов Числом энергетических уровней
- 6. Т.9 В молекуле белого фосфора химическая связь: Ионная Ковалентная полярная Ковалентная неполярная. Металлическая Т.10 в ряду
- 7. Т.11 При прокаливании 1 кг природного известняка было получено 201.6 л углекислого газа. Определите массовую долю
- 10. Валентность – количество связей, которые может образовать атом. Применяется для атомов, которые образуют ковалентные связи. Валентность
- 11. Валентности некоторых элементов неизменны: H – I, O – II, щелочные металлы – I, щелочно-земельные –
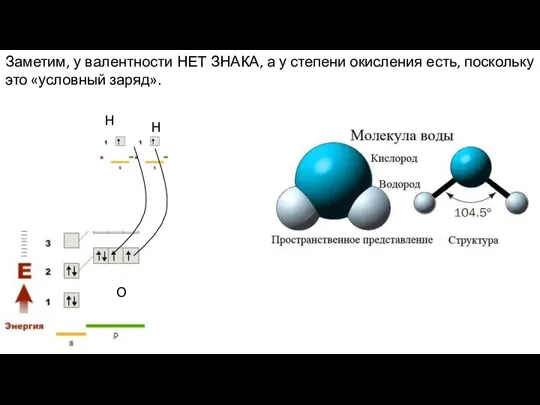
- 12. Заметим, у валентности НЕТ ЗНАКА, а у степени окисления есть, поскольку это «условный заряд». Н Н
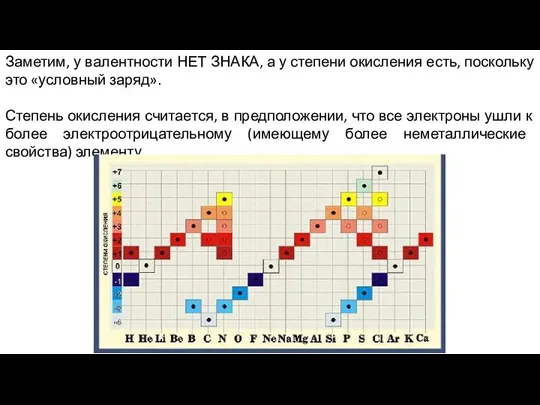
- 13. Заметим, у валентности НЕТ ЗНАКА, а у степени окисления есть, поскольку это «условный заряд». Степень окисления
- 14. Правила вычисления степеней окисления: Сумма степеней окисления атомов в соединении всегда равна нулю, в сложном ионе
- 15. Максимальная валентность и степень окисления равны номеру группы! Для главных подгрупп.
- 16. 3.1 В каком из этих веществ степень окисления какого-либо элемента не совпадает с валентностью? 2 ответа
- 17. 3.1 В каком из этих веществ степень окисления какого-либо элемента не совпадает с валентностью? 2 ответа
- 18. 3.2 В каком соединении степень окисления серы равна +4: SO3 Na2SO3 Na2SO4 Na2S
- 19. 3.2 В каком соединении степень окисления серы равна +4: SO3 Na2SO3 Na2SO4 Na2S Ангидрид и серная
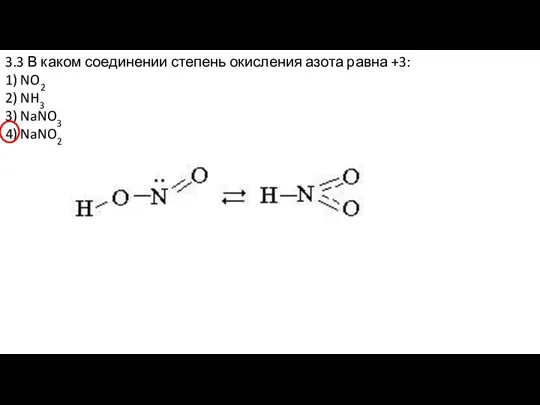
- 20. 3.3 В каком соединении степень окисления азота равна +3: 1) NO2 2) NH3 3) NaNO3 4)
- 21. 3.3 В каком соединении степень окисления азота равна +3: 1) NO2 2) NH3 3) NaNO3 4)
- 22. 3.4 В каком соединении степень окисления хлора равна +5: Хлористая кислота Хлорид натрия Гипохлорит бария Бертолетова
- 23. 3.4 В каком соединении степень окисления хлора равна +5: Хлористая кислота HClO2 Хлорид натрия NaCl Гипохлорит
- 24. 3.4 В каком соединении степень окисления хлора равна +5: Хлористая кислота HClO2 Хлорид натрия NaCl Гипохлорит
- 25. 3.5 В веществе, формула которого KNO2, степень окисления азота равна: -3 +3 -5 +5
- 26. 3.5 В веществе, формула которого KNO2, степень окисления азота равна: -3 +3 -5 +5
- 27. 3.6 Одинаковая степень окисления у фосфора в фосфате кальция и веществе, формула которого: Mg3P2 NaH2PO4 P4O6
- 28. 3.6 Одинаковая степень окисления у фосфора в фосфате кальция и веществе, формула которого: Mg3P2 NaH2PO2 P4O6
- 29. 3.7 Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых: HF – CH4 –H2O –NH3
- 30. 3.7 Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых: HF – CH4 –H2O –NH3
- 31. 3.8 В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные: +6, +2,
- 32. 3.8 В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные: +6, +2,
- 33. Реакции протекающие с изменением степеней окисления – называются окислительно-восстановительными реакциями (ОВР). 2Mg + CO2 ? 2MgO
- 34. 3.9 Используйте метод электронного баланса, расставьте коэффициенты в равнении реакции, схема которой H2S + HNO3 ?
- 35. 3.10 Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой HI + H2SO4 ?
- 36. Т.1 В каком соединении марганец имеет наибольшую степень окисления? KMnO4 K2MnO4 MnSO4 MnO2
- 37. Т.2 В порядке уменьшения валентности в высших оксидах элементы расположены в ряду: Сl? S ? P
- 38. Т.3 Атомы серы и углерода имеют одинаковую степень окисления в соединениях: H2S, CH4 H2SO4, CO SO2,
- 39. Т.4 Валентность каждого элемента равна II в веществе, формула которого: AlP MgS SiC MgCl2
- 40. Т.5 Валентность хрома равна 6 в вещества, формула которого: Cr(OH)3 CrO H2CrO4 CrO
- 41. Т.6 Отрицательная степень окисления химических элементов численно равна: Номеру группы в периодической системе Числу электронов, недостающих
- 42. Т.7 В каких соединениях фосфор и азот проявляют одинаковые степени окисления? PH3, NH4Cl P2O5, HNO3 NO2,
- 43. Т.8 Наименьшие значение степени окисления фосфор имеет в веществах: H3PO4 PH3 Na3PO4 Mg3P2 P2O5
- 44. Т.9 Каковы степень окисления и валентность атома по отношению друг к другу? Степень окисления всегда меньше
- 46. Скачать презентацию






































 Химическая кинетика
Химическая кинетика Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Коррозия металлов
Коррозия металлов Получение и распознавание водорода
Получение и распознавание водорода Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Чисті речовини та суміші. (7 клас)
Чисті речовини та суміші. (7 клас) Масс-Спектроскопия
Масс-Спектроскопия Понятие биогенности химических элементов
Понятие биогенности химических элементов NaCl или поваренная соль (плюсы и минусы)
NaCl или поваренная соль (плюсы и минусы) Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Карбоновые кислоты
Карбоновые кислоты Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Получение азотной кислоты
Получение азотной кислоты Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Альдегиды и кетоны
Альдегиды и кетоны Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Сорбіт C6H14O6
Сорбіт C6H14O6 Типы химических реакций
Типы химических реакций Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс Plastics слайды
Plastics слайды Удобрения. 9 класс
Удобрения. 9 класс 20230306_znachenie_periodicheskogo_zakona_d._i._mendeleeva
20230306_znachenie_periodicheskogo_zakona_d._i._mendeleeva Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Неизотермический процесс в химическом реакторе. Лекция 8
Неизотермический процесс в химическом реакторе. Лекция 8 Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника