Содержание
- 2. Содержание Общие понятия Скорость реакций в гомогенных и гетерогенных системах Энергия активации Влияние различных факторов на
- 3. Основные понятия химической кинетики Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие
- 7. Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется элементарный химический акт Мономолекулярная реакция: N2O5
- 8. Скорость реакции в гомогенных системах – средняя скорость реакции в интервале времени , – изменение количества
- 9. Cкорость реакции по различным реагентам Средняя скорость реакции 2NO(г) + O2 (г) = 2NO2 (г) по
- 10. Определение средней скорости реакции 0 α ∆С С0 С1 С Модуль I. Лекция 3. Химическая кинетика
- 11. Мгновенная скорость реакции (скорость в данный момент времени) равна первой производной от концентрации реагента по времени
- 12. В гетерогенной системе взаимодействие компонентов происходит на поверхности раздела фаз S - площадь поверхности раздела фаз,
- 13. Энергия активации Химическое взаимодействие осуществляется при столкновении частиц, которые обладают избытком энергии, достаточным для преодоления сил
- 14. Энергетическая диаграмма взаимодействия А2+В2=2АВ Схема образования активированного комплекса: А А А А А А + +
- 16. Влияние концентрации на скорость химической реакции Закон действующих масс: скорость элементарной химической реакции пропорциональна произведению концентраций
- 24. Особенности гетерогенных реакций Стадии гетерогенных реакций : подвод вещества к реакционной поверхности химическое взаимодействие отвод продукта
- 25. Влияние давления на скорость химической реакции Влияние давления существенно для реакций с участием газообразных веществ, так
- 26. Правило Вант-Гоффа При повышении температуры на каждые 100 скорость большинства реакций увеличивается в 2÷4 раза: и
- 28. Влияние температуры на скорость химической реакции Распределение частиц по энергиям при температурах Т1 и Т2 (распределение
- 29. Зависимость константы скорости от температуры Уравнение Аррениуса Еа ‑ энергия активации, кДж/моль R ‑ универсальная газовая
- 30. Влияние катализаторов на скорость химической реакции Катализаторы - вещества, увеличивающие скорость реакции и остающиеся в конце
- 31. Влияние катализатора
- 35. Заключение Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие на них Скорость
- 37. Скачать презентацию
 Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Губна помада та ії призначення
Губна помада та ії призначення Тақырып. Ароматик көмірсутектер
Тақырып. Ароматик көмірсутектер Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Типы химических реакций
Типы химических реакций Сахароза
Сахароза Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Комплексные соединения
Комплексные соединения Основные понятия и законы химии. 10 класс
Основные понятия и законы химии. 10 класс Алгоритм определения вида связи по формуле вещества
Алгоритм определения вида связи по формуле вещества Относительная атомная масса химических элементов. Знаки химических элементов
Относительная атомная масса химических элементов. Знаки химических элементов Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Химические элементы азот и фосфор
Химические элементы азот и фосфор Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Азот и его соединения
Азот и его соединения Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома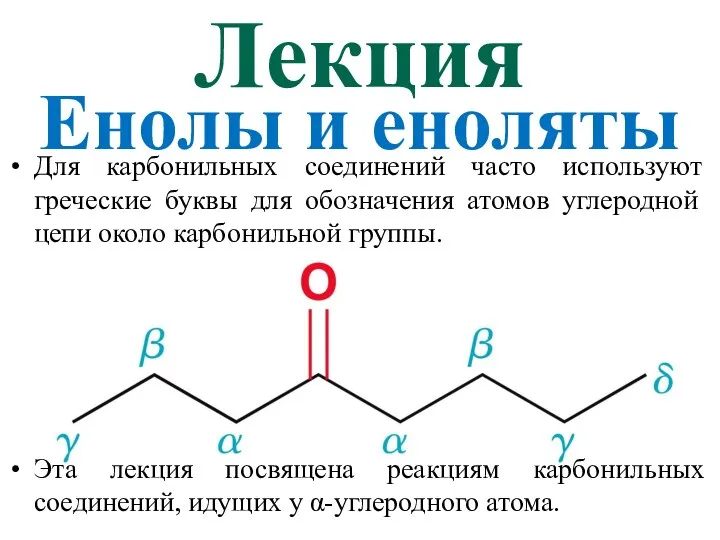 Енолы и еноляты
Енолы и еноляты Приготовление раствора сахара и расчёт его массовой доли в растворе. Практическая работа
Приготовление раствора сахара и расчёт его массовой доли в растворе. Практическая работа Классификация неорганических веществ
Классификация неорганических веществ Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii