Содержание
- 2. УМК «ХИМИЯ» Тема лекции: Комплексные соединения Лектор – Иванов М.Г.
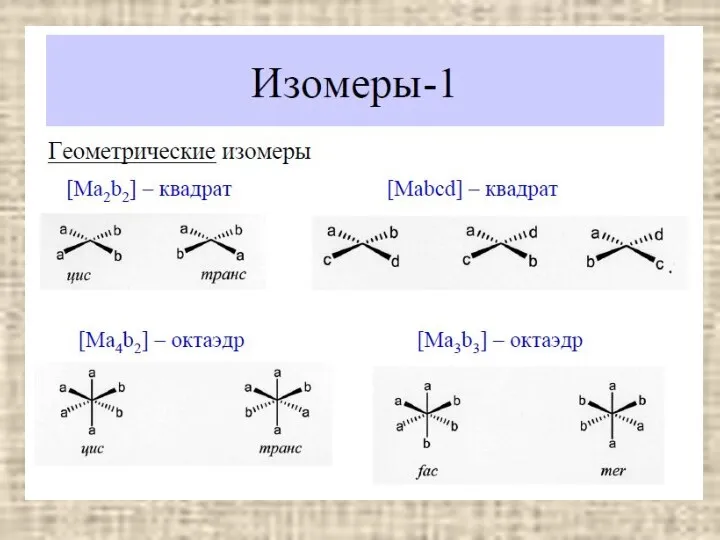
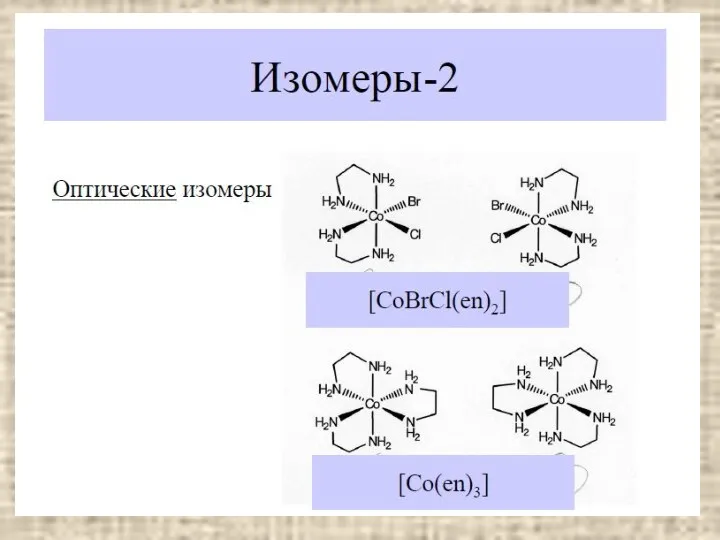
- 3. СОДЕРЖАНИЕ Основные понятия Классификация Номенклатура Изомерия Геометрическая Оптическая Связевые изомеры Гидратные и ионизационные изомеры Конформационные изомеры
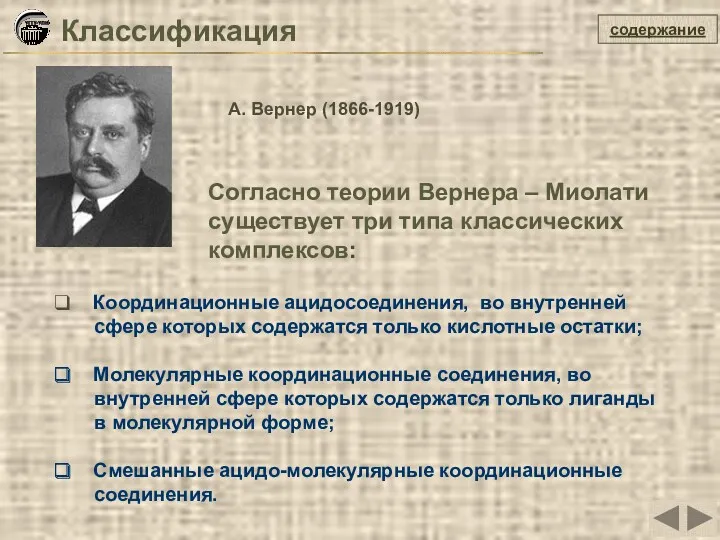
- 6. Классификация Координационные ацидосоединения, во внутренней сфере которых содержатся только кислотные остатки; Молекулярные координационные соединения, во внутренней
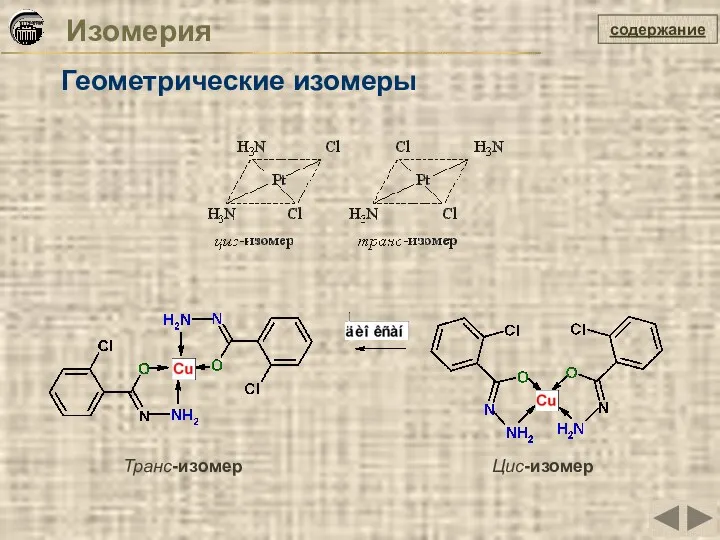
- 9. Изомерия Геометрические изомеры содержание Транс-изомер Цис-изомер
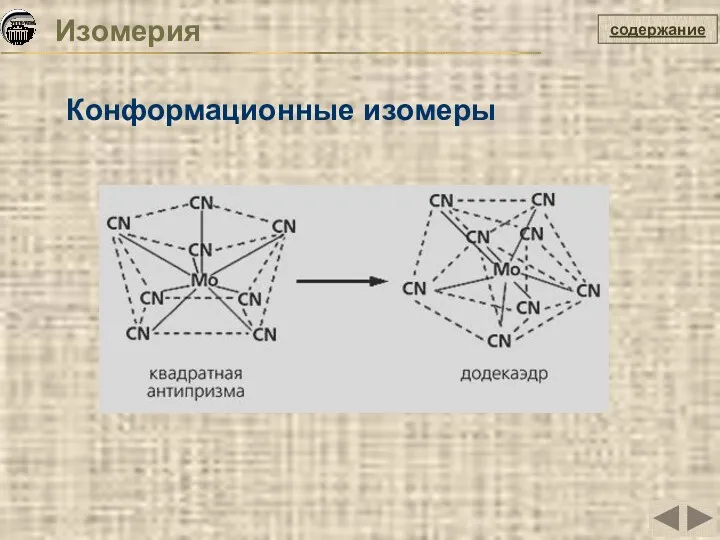
- 14. Изомерия Конформационные изомеры содержание
- 15. Лиганды Типы: содержание нейтральные: H2O, NH3, CO, Н2N-CH2-CH2-NH2 анионы: Cl-, OH-, CN-, F-, оксалат-ион- С2O42- Дентатность:
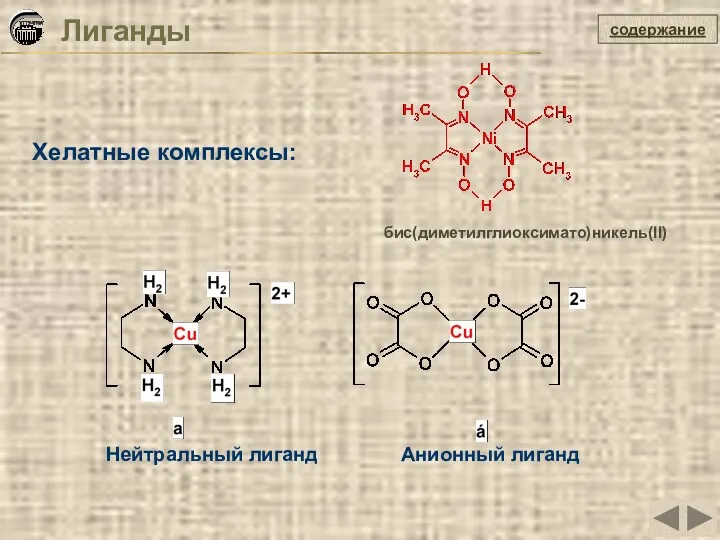
- 16. Хелатные комплексы: Лиганды содержание Нейтральный лиганд Анионный лиганд бис(диметилглиоксимато)никель(II)
- 17. Лиганды Макроциклический содержание [Ni(H2O)6]2+ + n L [Ni(L)n(H2O)2]2+ + 4H2O
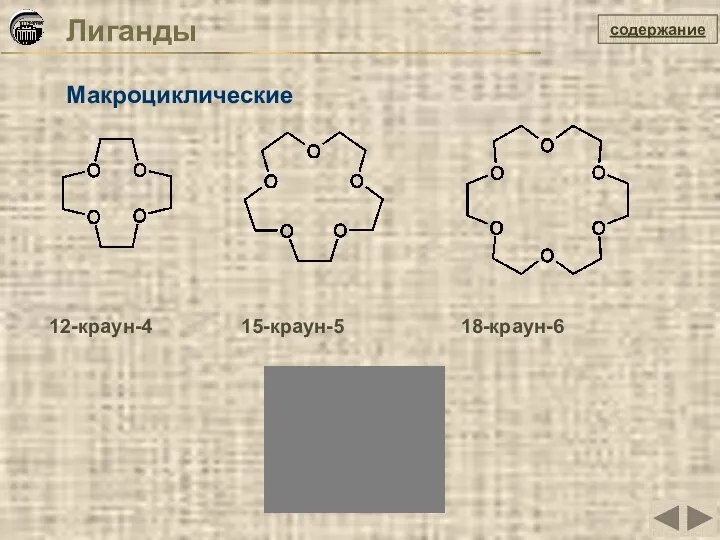
- 18. Лиганды содержание Макроциклические 12-краун-4 15-краун-5 18-краун-6
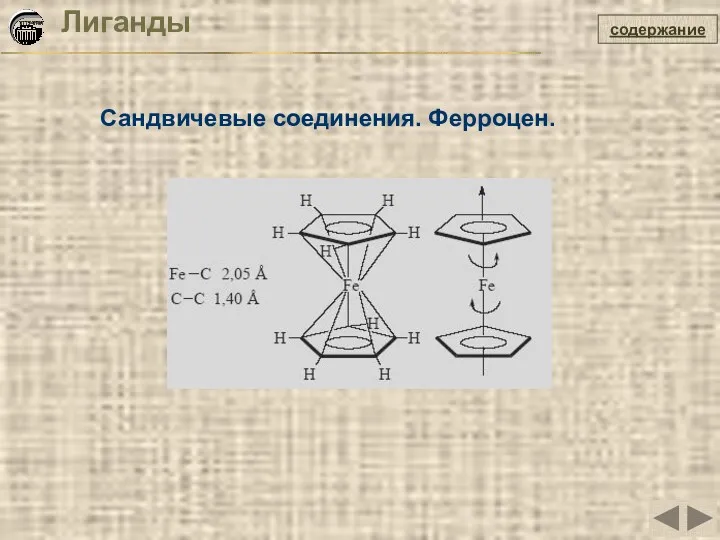
- 19. Лиганды Сандвичевые соединения. Ферроцен. содержание
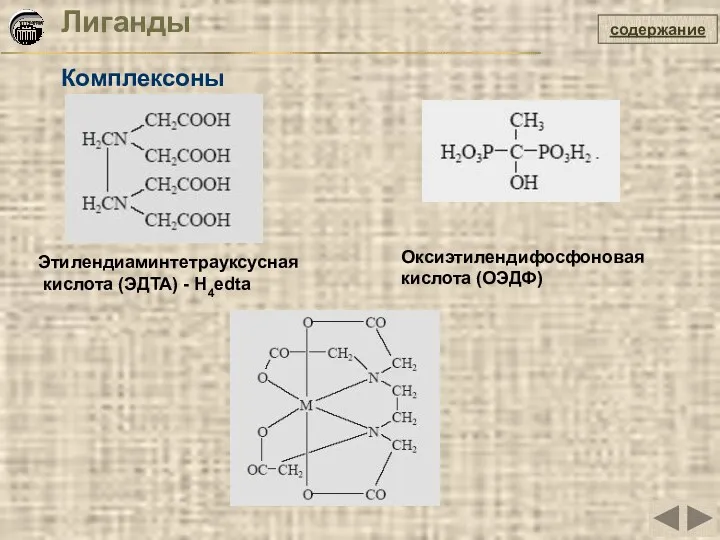
- 20. Лиганды Комплексоны содержание Этилендиаминтетрауксусная кислота (ЭДТА) - H4edta Оксиэтилендифосфоновая кислота (ОЭДФ)
- 21. Многоядерные комплексы Многоядерный комплекс относят к кластерному типу, когда атомы комплексообразователя непосредственно связаны между собой: ион
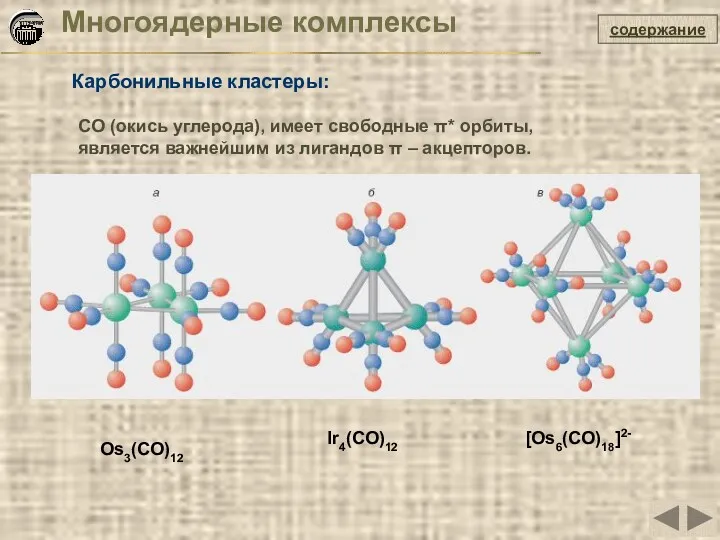
- 22. Многоядерные комплексы Карбонильные кластеры: содержание Os3(CO)12 CO (окись углерода), имеет свободные π* орбиты, является важнейшим из
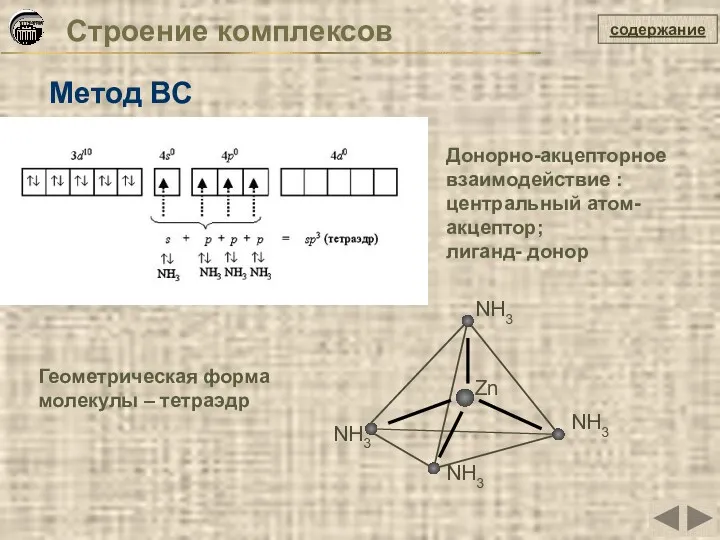
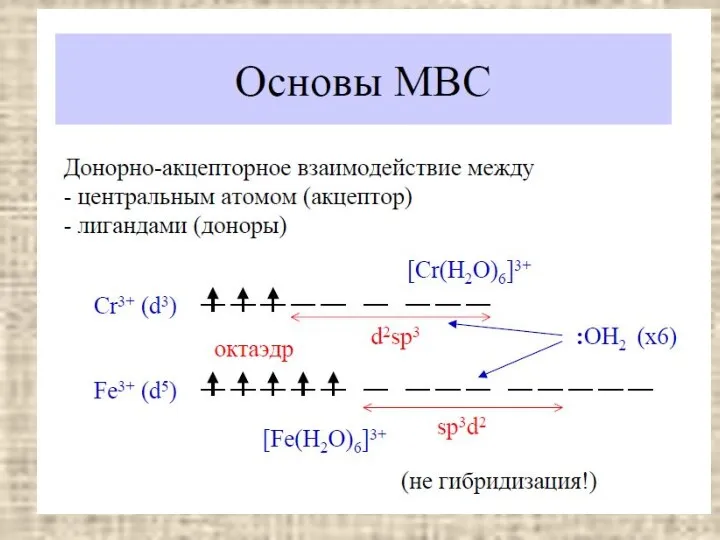
- 23. Строение комплексов Метод ВС Zn NH3 NH3 NH3 NH3 Геометрическая форма молекулы – тетраэдр содержание Донорно-акцепторное
- 26. Строение комплексов Теория кристаллического поля Химическая связь комплексообразователь – лиганд считается электростатической Лиганды располагаются вокруг комплексообразователя
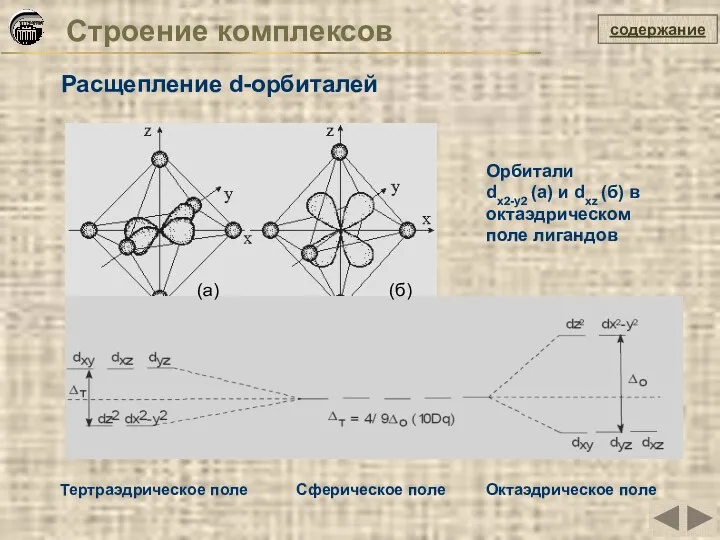
- 28. Строение комплексов Расщепление d-орбиталей содержание Орбитали dх2-у2 (а) и dxz (б) в октаэдрическом поле лигандов (а)
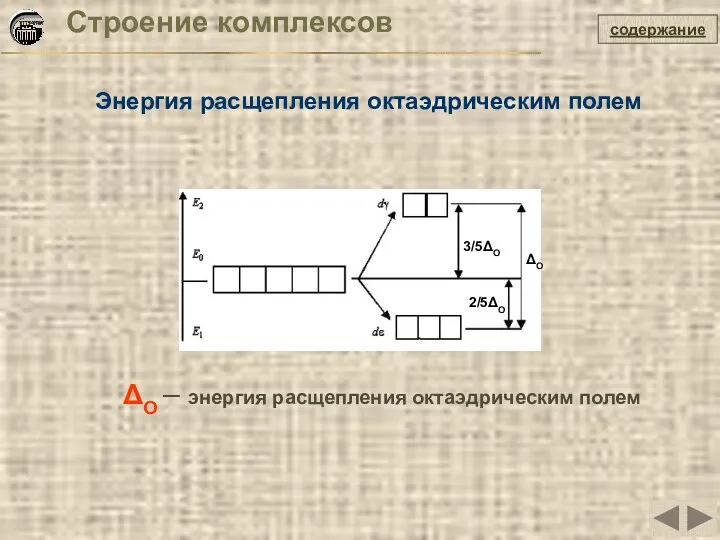
- 29. Строение комплексов Энергия расщепления октаэдрическим полем содержание ΔO – энергия расщепления октаэдрическим полем ΔO 2/5ΔO 3/5ΔO
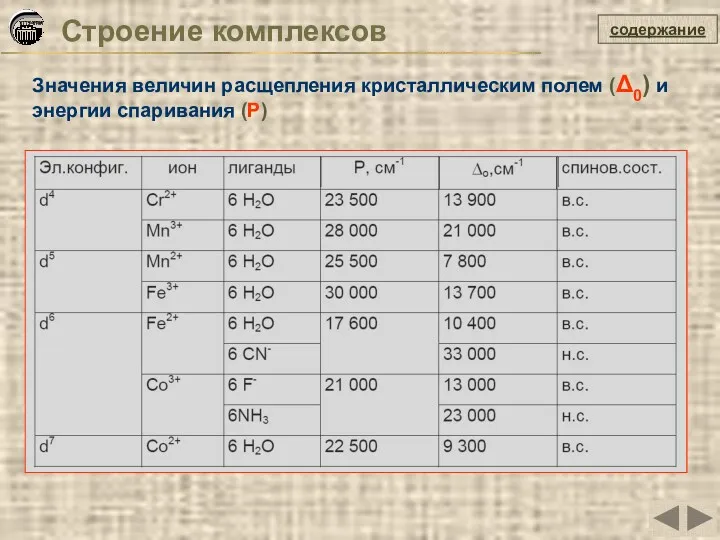
- 30. Строение комплексов Значения величин расщепления кристаллическим полем (Δ0) и энергии спаривания (P) содержание
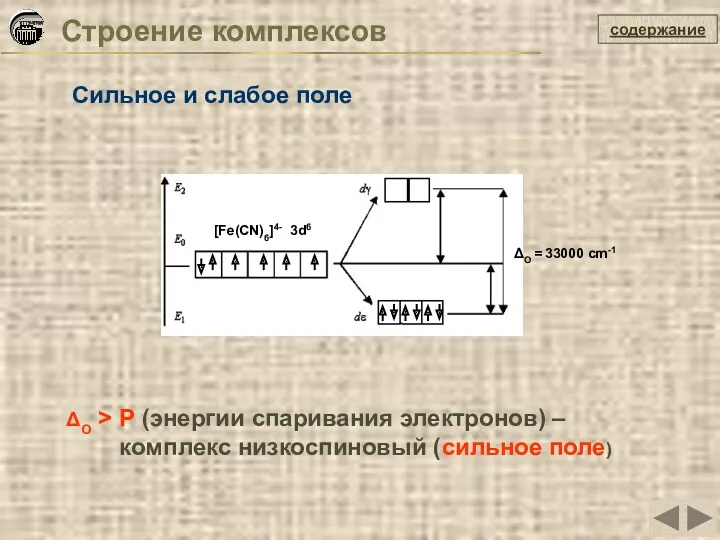
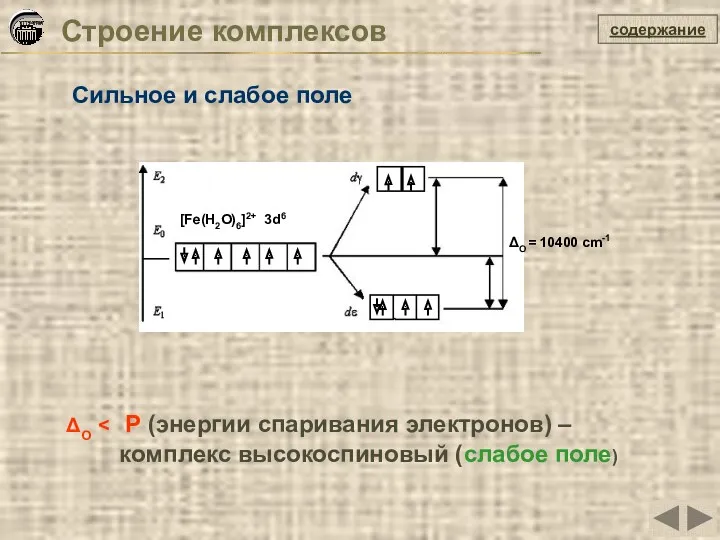
- 31. Строение комплексов содержание Сильное и слабое поле ΔO > P (энергии спаривания электронов) – комплекс низкоспиновый
- 32. Строение комплексов содержание Сильное и слабое поле ΔO комплекс высокоспиновый (слабое поле) [Fe(H2O)6]2+ 3d6 ΔO =
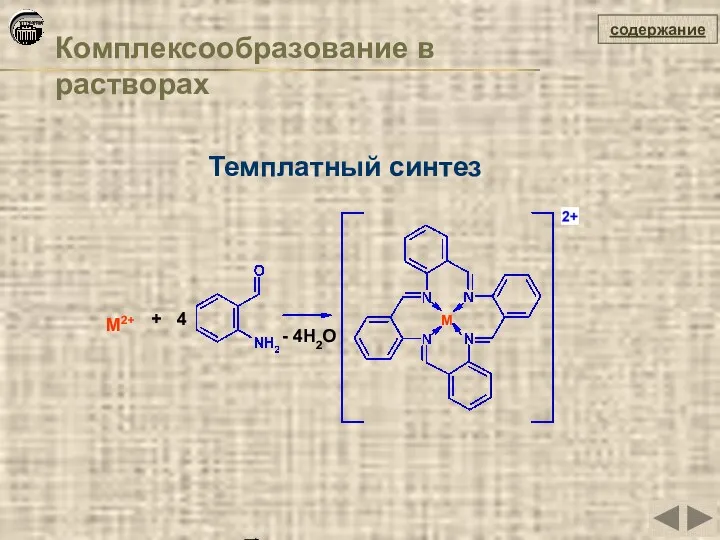
- 36. Комплексообразование в растворах содержание Темплатный синтез M2+ M + 4 - 4H2O
- 38. Устойчивость комплексов содержание [М(H2O)6]n+ + m L [M(L)m(H2O)k]n+ + (6-k)H2O Куст = [M(L)m n+] [L]m [Mn+]
- 39. Устойчивость комплексов содержание [М]n+ + L [ML]n+ ; К1 = [MLn+] [L] [Mn+] К2 = ΔG0
- 40. Разрушение комплексов содержание
- 41. Устойчивость комплексов содержание Константы нестойкости некоторых комплексов
- 43. Химия комплексных соединений важнейшей является частью неорганической химии. Знание о природе взаимодействия атомов металла и лигандов
- 45. Скачать презентацию









![Лиганды Макроциклический содержание [Ni(H2O)6]2+ + n L [Ni(L)n(H2O)2]2+ + 4H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/218162/slide-16.jpg)








![Устойчивость комплексов содержание [М(H2O)6]n+ + m L [M(L)m(H2O)k]n+ + (6-k)H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/218162/slide-37.jpg)
![Устойчивость комплексов содержание [М]n+ + L [ML]n+ ; К1 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/218162/slide-38.jpg)




 яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Азот
Азот Элемент V группы фосфор
Элемент V группы фосфор Соли. Свойства солей
Соли. Свойства солей Петрография
Петрография Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар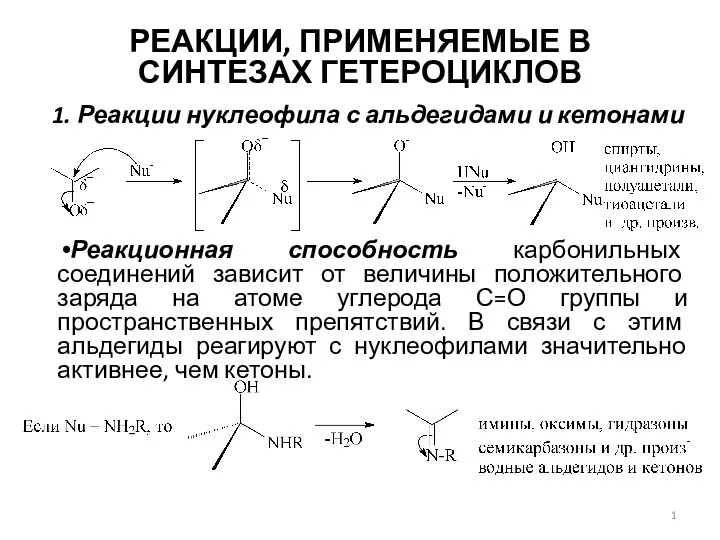 Реакции, применяемые в синтезах гетероциклов
Реакции, применяемые в синтезах гетероциклов Роль ферментов в формировании потребительских свойств продовольственных товаров
Роль ферментов в формировании потребительских свойств продовольственных товаров Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов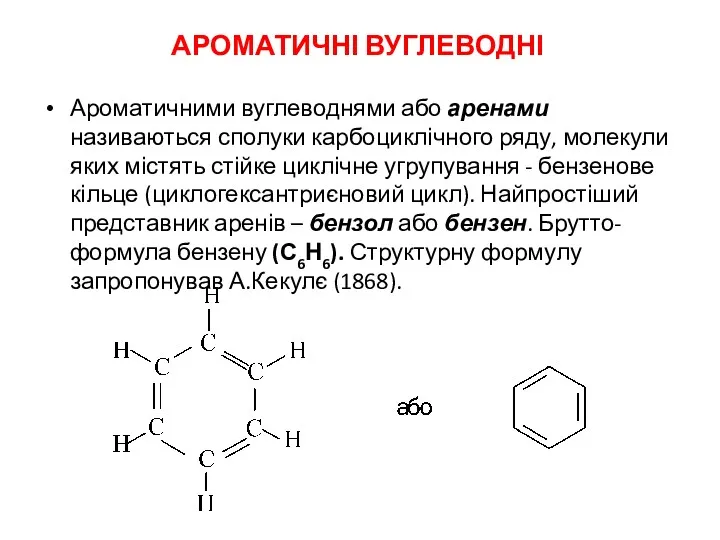 Ароматичні вуглеводні
Ароматичні вуглеводні Химический элемент фосфор
Химический элемент фосфор Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Кобальт. Химический элемент
Кобальт. Химический элемент Кластер Химические реакции
Кластер Химические реакции Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Углеводы - 2
Углеводы - 2 Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде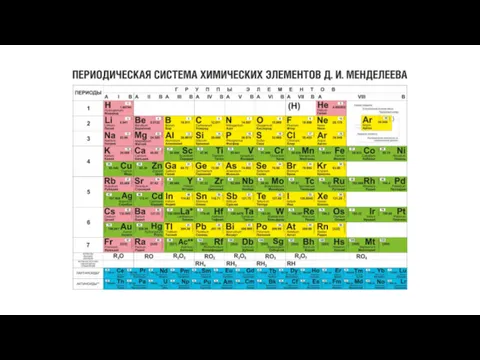 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Алкины. Ацетилены
Алкины. Ацетилены Краткая история химии
Краткая история химии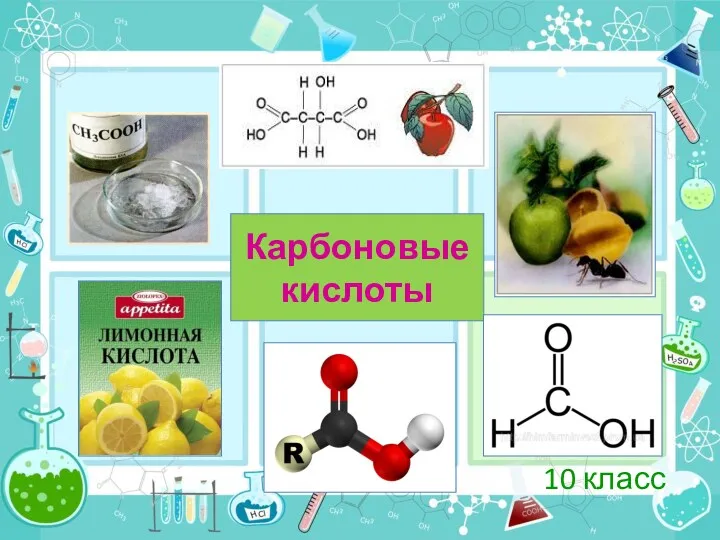 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Гетероциклды қосылыстар. Алкалоидтар
Гетероциклды қосылыстар. Алкалоидтар Реакционная способность соединений со связью углерод-гетероатом
Реакционная способность соединений со связью углерод-гетероатом Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс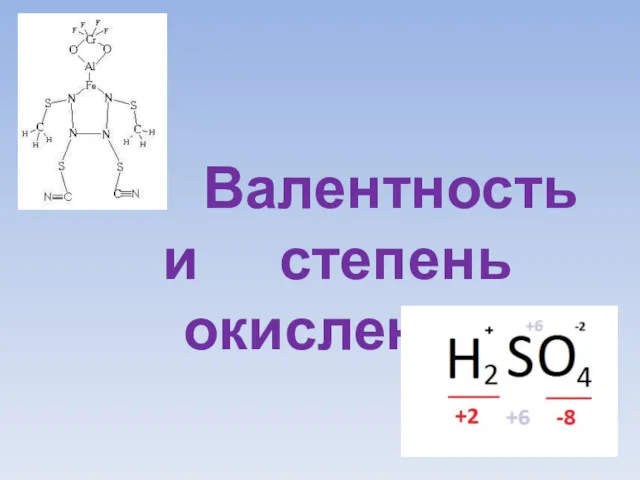 Валентность и степень окисления
Валентность и степень окисления Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп