Содержание
- 2. Содержание : 1.Пути обмена глюкозо-6 фосфата в тканях 2.Анаэробное расщепление глюкозы 3.Спитровое брожение 4.Аэробный гликолиз 5.Регуляция
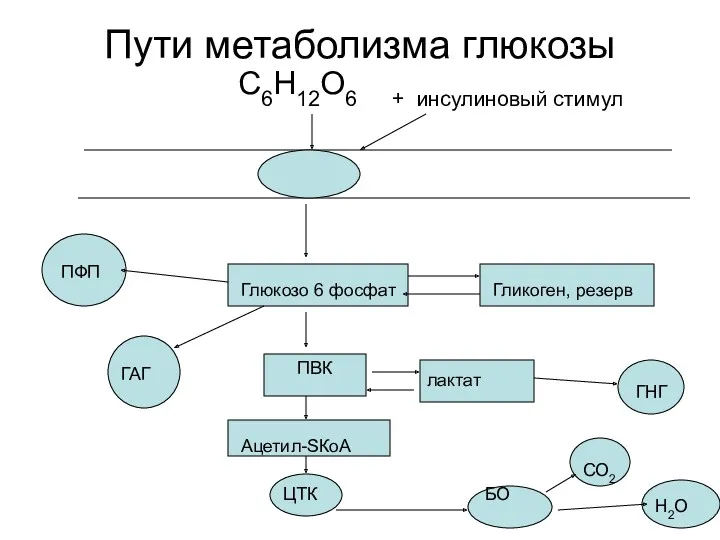
- 3. Пути метаболизма глюкозы С6Н12О6 + инсулиновый стимул Глюкозо 6 фосфат ПВК лактат ГНГ Гликоген, резерв ПФП
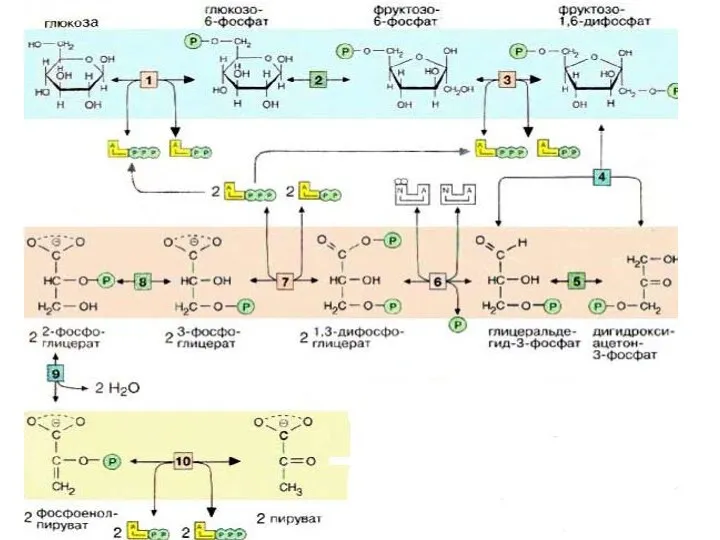
- 4. Гликолиз Это центральный путь энергетичекого обмена протекает без окислительных реакций. В анаэробных условиях –гликолиз единственный процесс,
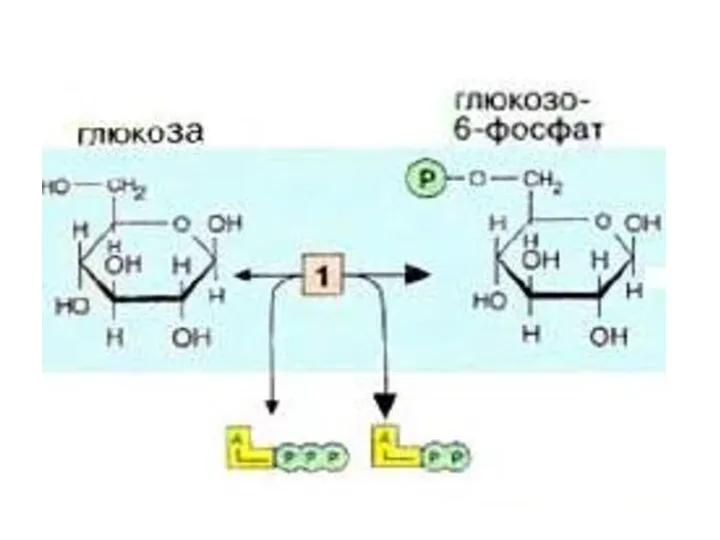
- 8. Первой реакцией гликолиза является фосфорилирование Гл. В результате этой реакции образуется большое количество энергии, которая сразу
- 9. В печени, почках, поджелудочной железе есть глюкокиназа, которая катализирует только фосфорилирование глюкозы. Она не ингибируется Гл-6-ф.
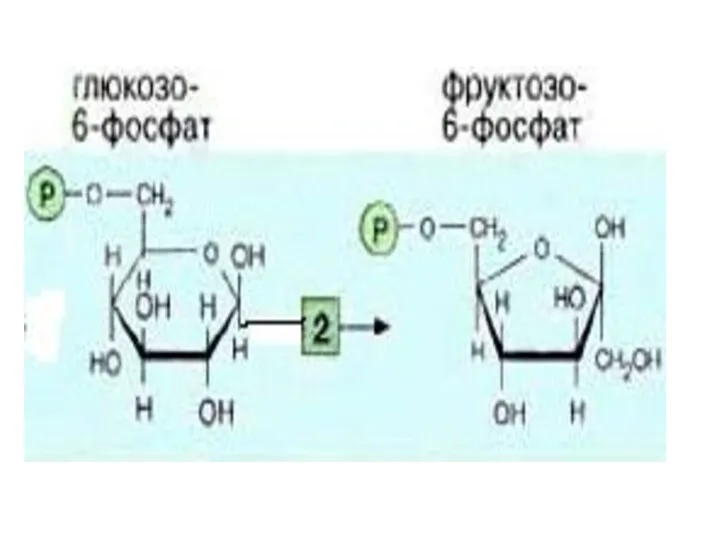
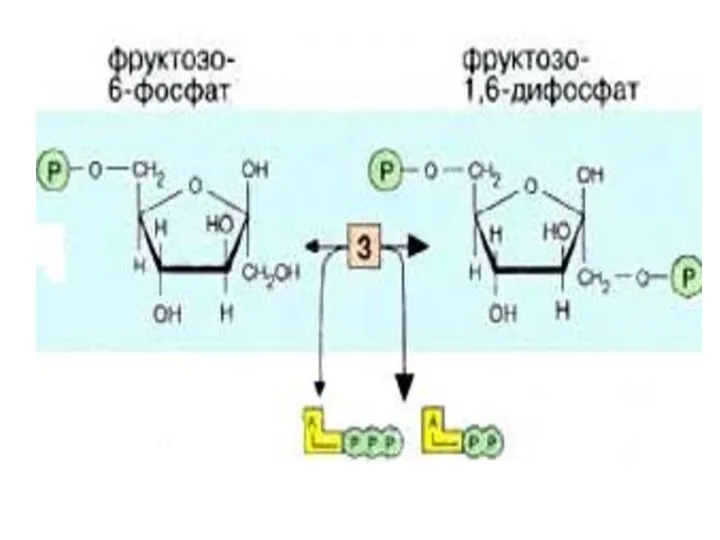
- 12. 3-я реакция - Фосфофруктокиназная (ФФК) реакция определяет скорость гликолиза в целом( т.е. является лимитирующей). ФФК относится
- 13. Различают регуляторную и субстратную концентрацию АТФ. Км для субстратного и регуляторного центров ФФК будут различны, и
- 14. При снижении этого коэффициента интенсивность гликолиза увеличивается. Так в неработающей мышце ( АТФ) ↑, гликолиз снижается.
- 15. 4
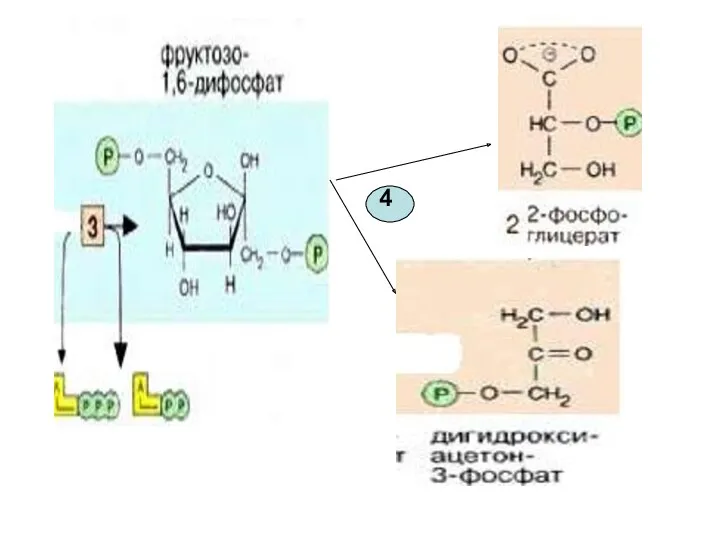
- 16. 4-я реакция обратима. Фермент-альдолаза Разрыв связи происходит в результате напряжения между атомами С3 и С4. Расщепляется
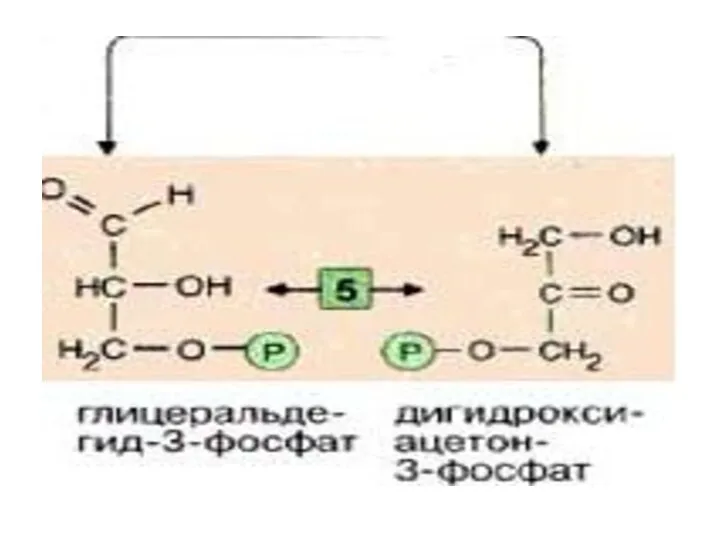
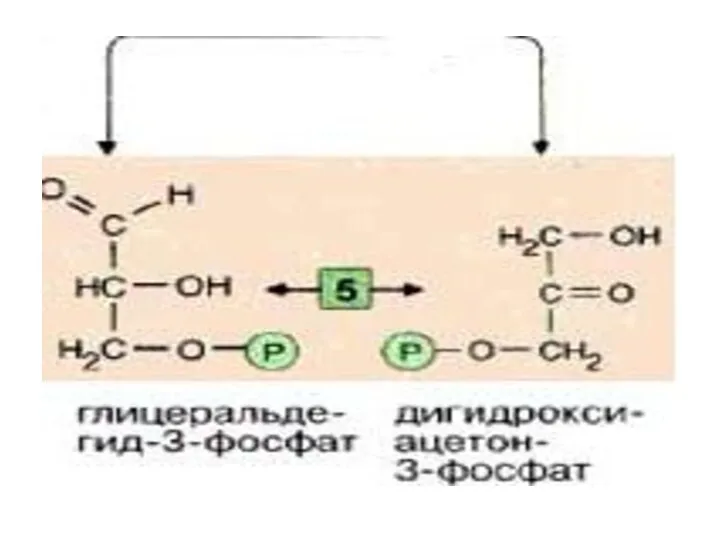
- 18. Именно в силу последнего обстоятельства, обратимая триозофосфатизомеразная реакция также смещается в сторону образования 3-ФГА( дальнейшие реакции
- 19. Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5].
- 21. Определение активности альдолазы используют в энзимодиагностике при заболеваниях, связанных с повреждением или гибелью клеток: так, при
- 22. Таким образом заканчивается первый подготовительный и энергопотребляющий этап гликолиза, связанный с вкладыванием энергии в процесс активации
- 23. II этап гликолиза – гликолитическая оксидоредукция. Глицеральдегид-3-фосфат затем окисляется глицеральдегид-З-фосфатдегидрогеназой [6] с образованием НАДН+Н+. Реакция контролируется
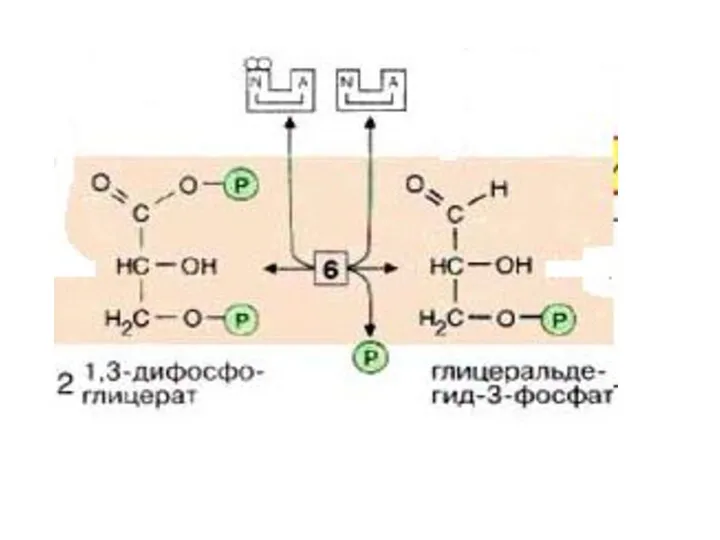
- 25. В этой реакции в молекулу включается неорганический фосфат («субстратное фосфорилирование»,) с образованием 1,3-дифосфоглицерата- 1,3ДФГ. Такое промежуточное
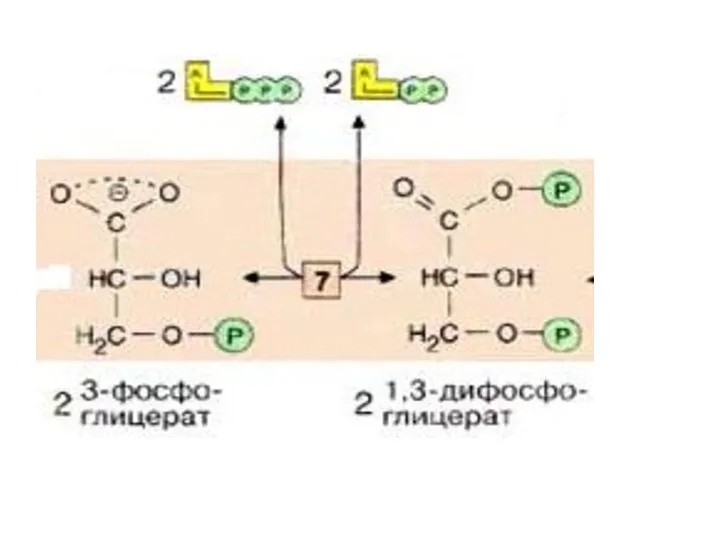
- 26. На следующей стадии (катализируемой фосфоглицераткиназой [7]), гидролиз этого соединения сопряжен с образованием АТФ. Эта реакция является
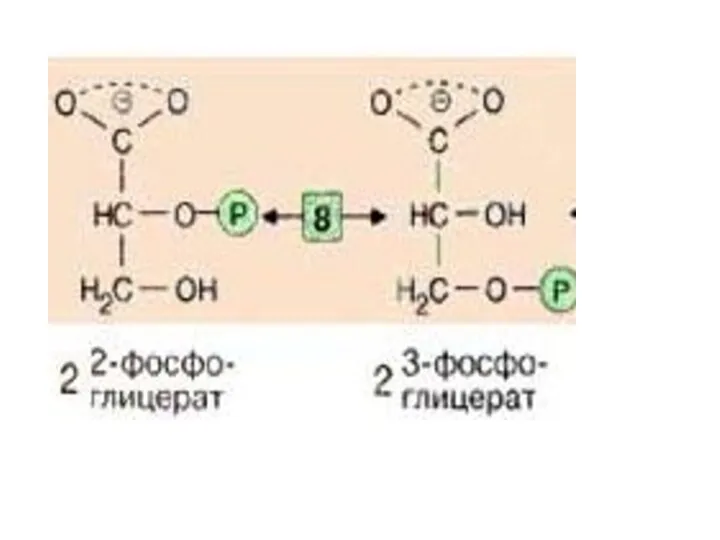
- 28. Следующий промежуточный продукт, гидролиз которого может быть сопряжен с синтезом АТФ, образуется в реакции изомеризации 3-фосфоглицерата,
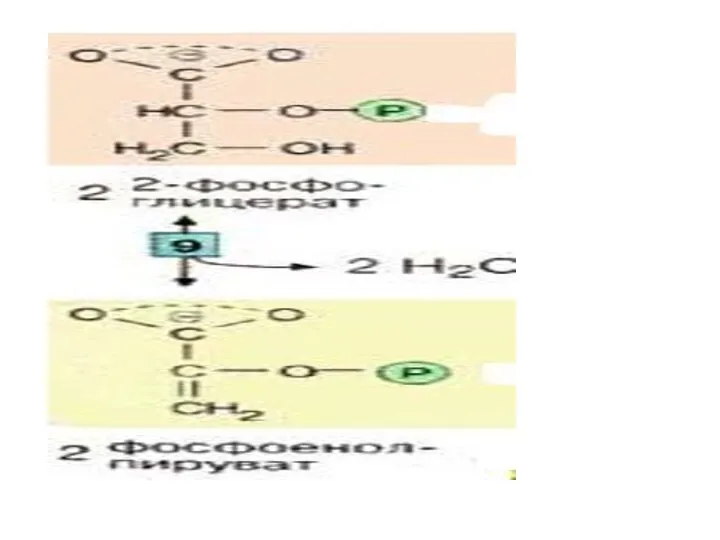
- 30. Далее происходит отщепление воды (фермент: енолаза [9]). Продукт представляет собой сложный эфир фосфорной кислоты и енольной
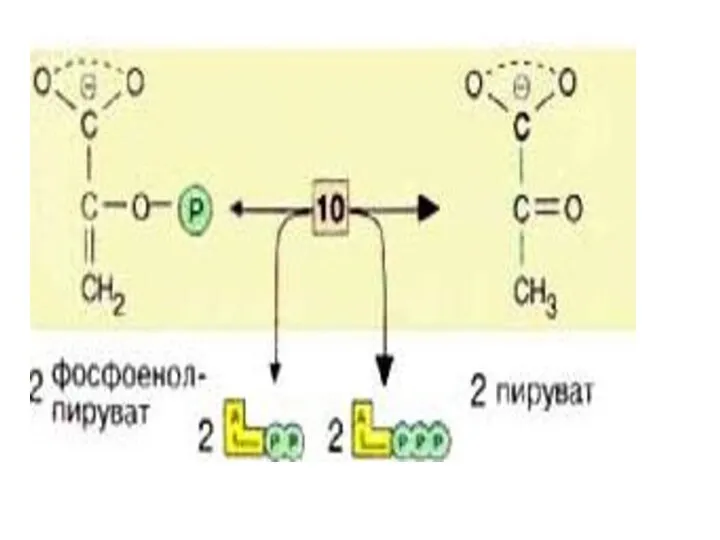
- 32. На последней стадии, которая катализируется пируваткиназой [10], образуются пируват и АТФ. Наряду со стадией [6] и
- 34. При гликолизе на активацию одной молекулы глюкозы потребляется 2 молекулы АТФ. В то же время при
- 35. Ферменты гликолиза, кроме альдолазы нуждаются ионах Мg++
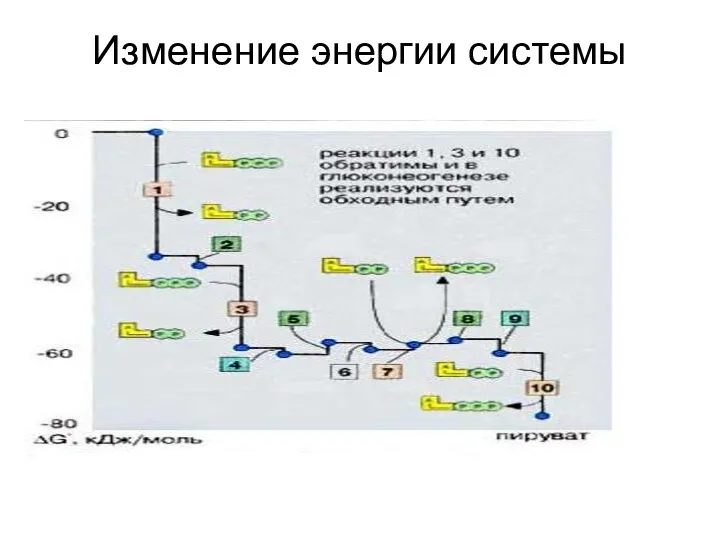
- 36. Изменение энергии системы
- 37. Энергетический баланс гликолиза В 1-й стадии гликолиза затрачивается 2 молекулы АТФ ( гексокиназная и фосфофруктокиназная реакции).
- 38. Биологическое значение гликолиза 1. Филогенетически самый древний способ получения энергии 2.Для клеток с малым числом митохондрий
- 39. 4.Роль гликолиза для отдельных клеток. В мышцах гликолиз поставляет АТФ. В гепатоцитах фрагменты гликолиза используются в
- 40. В эритроцитах гликолиз это единственный путь получения энергии, поскольку в эритроцитах нет митохондрий. Наследственный дефект пируваткиназы
- 41. Контроль гликолиза осуществляется ЛДГ и ее изоферментами. В тканях с аэробным метаболизмом ( сердце, почки) преобладают
- 42. В анаэробных тканях( печень, мышцы) преобладает ЛДГ4 и ЛДГ5. Активность ЛДГ5 максимальна при той концентрации ПВК,
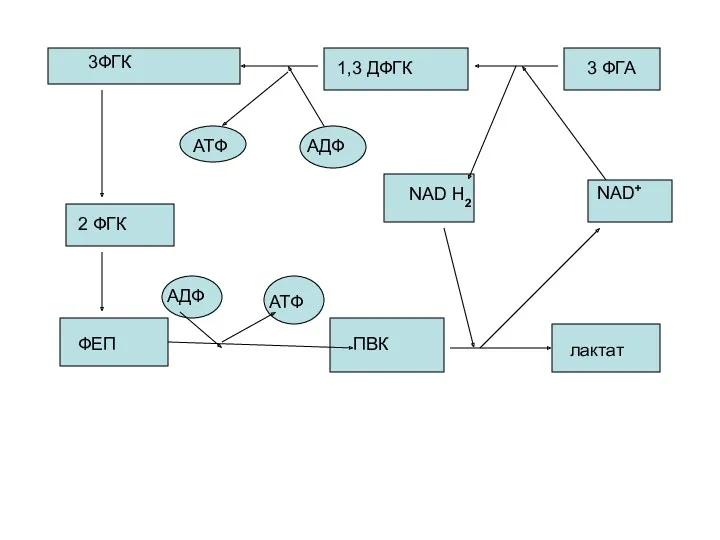
- 43. Механизм гликолитической оксидоредукции. Субстратное фосфорилирование
- 44. 3ФГК 1,3 ДФГК 3 ФГА 2 ФГК ФЕП ПВК лактат АТФ АДФ АДФ АТФ NAD H2
- 45. Это цикл гликолитической оксидоредукции. Ключевое значение имеет реакция 3ФГА----? 1,3 ДФГК, механизм которой расшифрован. Здесь также
- 46. Кроме этих двух существует еще 2 киназные реакции, в них АТФ не образуется, а расходуется. Киназные
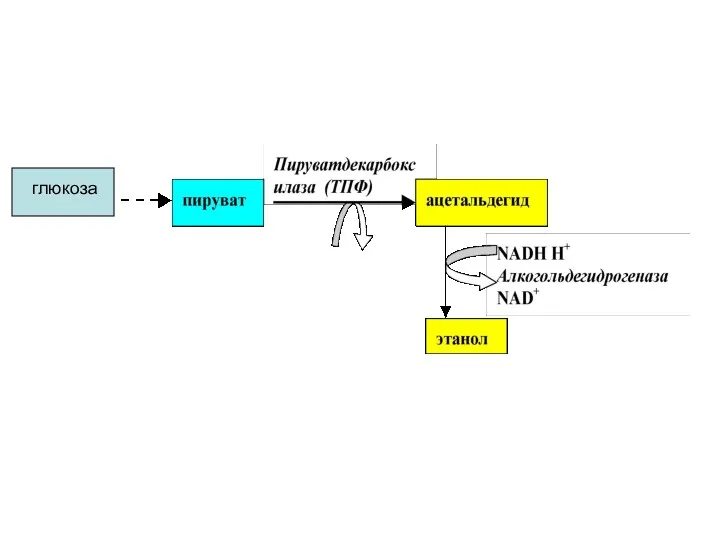
- 47. Спиртовое брожение В тканях различных организмов имеются ферменты, расщепляющие глюкозу до этанола. Этот процесс называется спиртовым
- 48. глюкоза
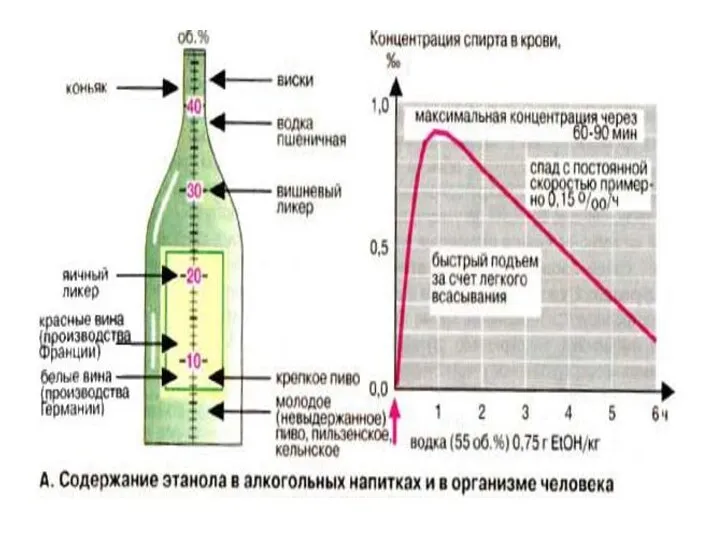
- 49. Этанол является уникальным веществом,т.к. представлен в двух видах: 1. В роли эндогенного метаболита. Его концентрация в
- 52. Введение этанола приводит к сдвигам в нервной системе, которые обусловлены образованием продуктов конденсации СН3СОН с биогенными
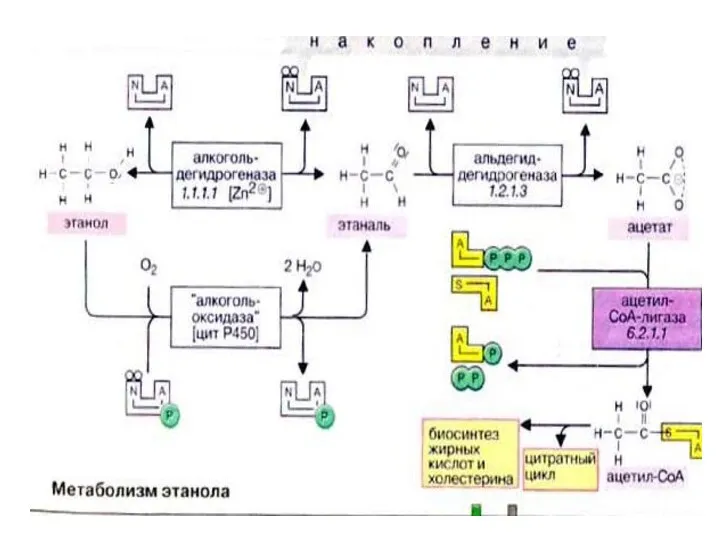
- 53. Пути метаболизма этанола NAD+; АлДГ 1.СН3СН2ОН Где АлДГ- алкогольдегидрогеназа ( NAD зависимая) CН3СОН – это центральный
- 54. Дальнейшее окисление ацетальдегида: HSKoA CН3СОН-----------?СН3СО SКоА---?ЦТК ↓[O] ↓ СН3СООН Н Н | l СН3---С =О +
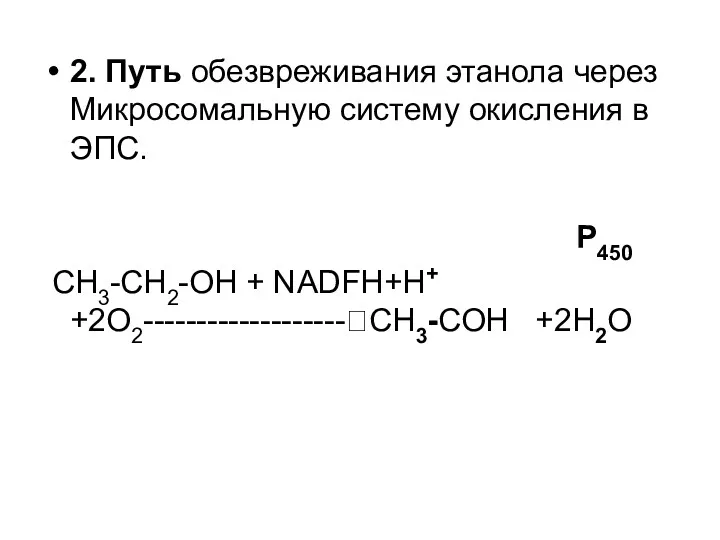
- 55. 2. Путь обезвреживания этанола через Микросомальную систему окисления в ЭПС. P450 СН3-СН2-ОН + NADFH+H+ +2O2-------------------?СН3-СОН +2Н2О
- 56. 3.путь обезвреживания этанола – пероксидазный, минорный каталазный СН3-СН2-ОН +Н2О2 --*-? СН3СОН + 2Н2О где *- каталаза
- 57. Метаболические последствия интоксикации этанолом Этанол лимитирует основной фонд NAD+, переводя его в NADH, и это приводит
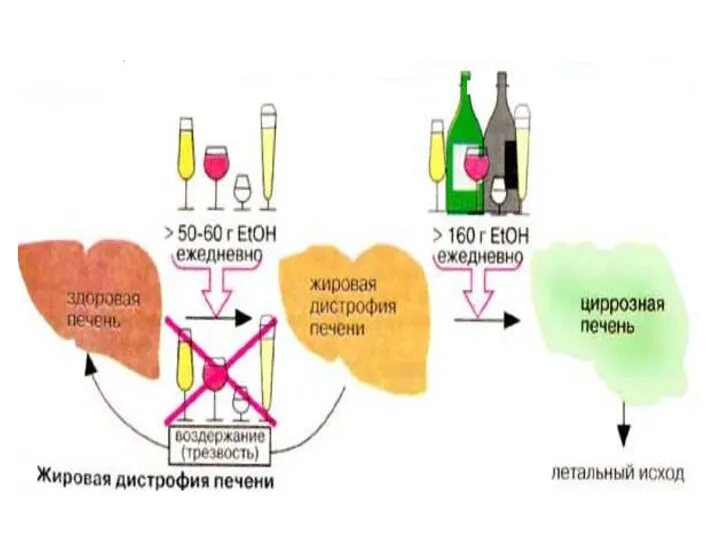
- 58. При приеме этанола увеличивается активность каталазы,которая провоцирует перекисные процессы, следствием чего является развитие патологии печени, сердца
- 59. Этанол хорошо растворяется в воде и липидах. Он растворим в клеточных мембранах, и увеличивает их текучесть.
- 60. ЖК должны окисляться под действием NAD-зависимых ДГ,но эти реакции блокируются. При длительном использовании этанола, печень просто
- 62. Второй причиной яв-ся образование ацетил-КоА, из этанола, который также идет на биосинтез ЖК, тем самым усугубляя
- 63. Аэробный гликолиз. Окислительное декарбоксилирование ПВК
- 64. Аэробный гликолиз. При анаэробном гликолизе ПВК превращается в лактат, в случае аэробного гликолиза ПВК подвергается окислительному
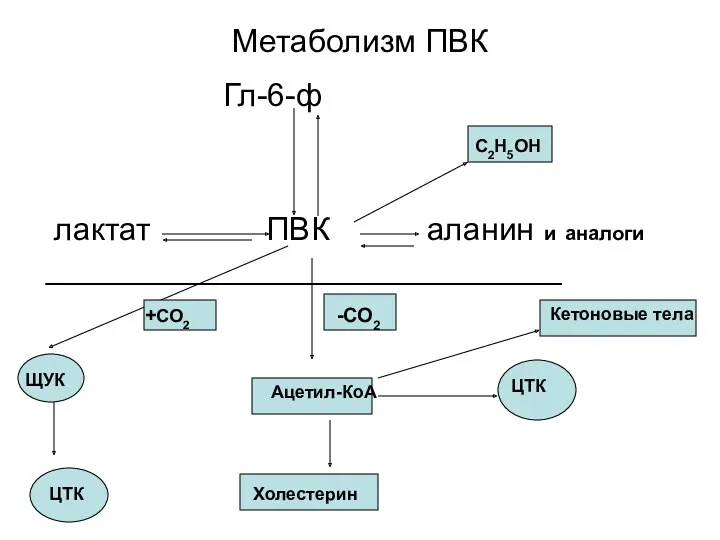
- 65. Метаболизм ПВК Гл-6-ф лактат ПВК аланин и аналоги _____________________________ Ацетил-КоА ЦТК Холестерин С2Н5ОН Кетоновые тела ЩУК
- 66. Пируват, образовавшийся в реакциях гликолиза (в цитоплазме), должен быть транспортирован в митохондрии. Транспорт осуществляется специальной «челночной»
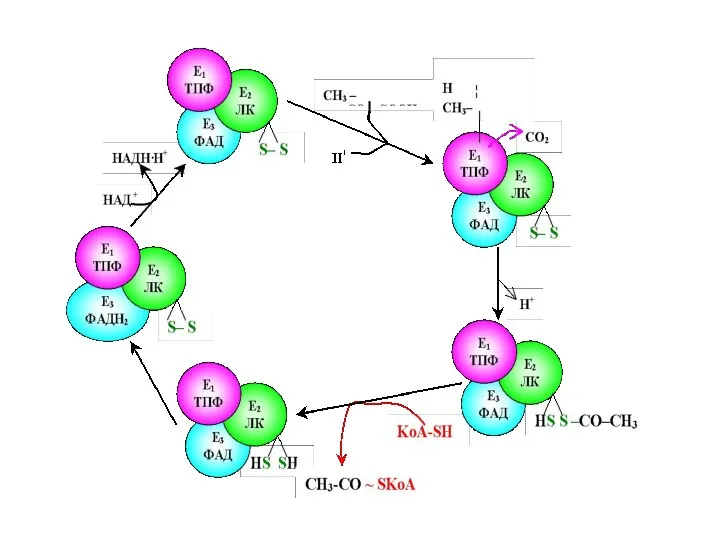
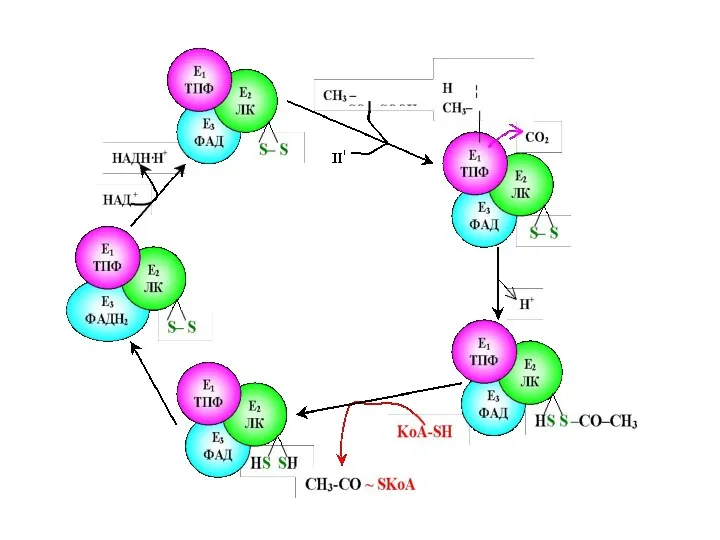
- 67. Пируватдегидрогеназный комплекс включает три фермента: пируватдегидрогеназу,липоатацетил- трансферазу липоамиддегидрогеназу и пять коферментов- NAD, FAD, тиаминдифосфат (TPP), KoA,
- 69. Пируватдегидрогеназа состоит из 60 полипептидных цепей, которые можно разделить на 3 основных фермента: Е1 – собственно
- 71. Е1 катализирует декарбоксилирование ПВК с участием кофермента тиаминпирофосфата (ТРР). Образовавшийся продукт реакции (гидроксиэтильное производное ТРР) при
- 72. Дисульфидная группа липоевой кислоты способна восстанавливаться и ацетилироваться. В реакции, катализируемой дигидролипоилтрансацетилазой (Е2 ), образуется ацетиллипоевая
- 73. Наконец, начинает функционировать Е3, коферментом которого является ФАД: кофермент окисляет дигидролипоевую кислоту и сам при этом
- 74. Таким образом, в окислительном декарбоксилировании ПВК участвует фактически 3 фермента, составляющих единый пируватдегидрогеназный комплекс, и 5
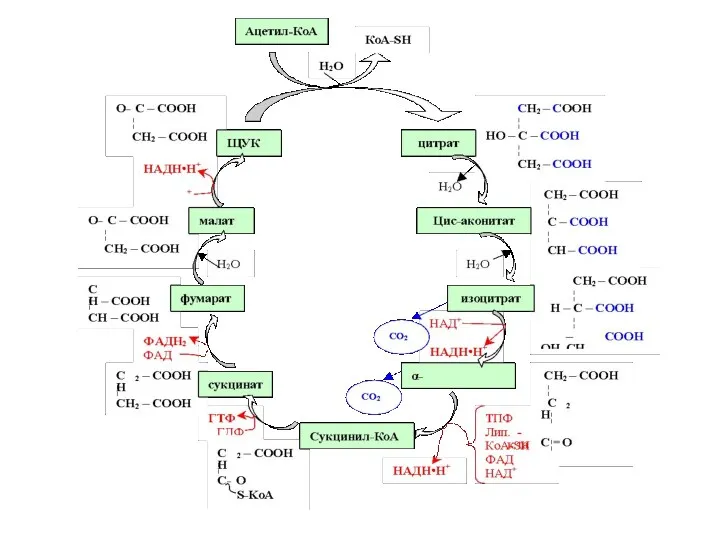
- 76. Образующийся ацетил-КоА затем окисляется в цикле Кребса, а водород с NADН ·Н+ поступает в дыхательную цепь
- 77. При недостаточном содержании в диете входящих в состав ПВК-ДГ витаминов, в первую очередьТРР, активность фермента снижается.
- 78. При выраженном дефиците тиамина развивается некомпенсированный ацидоз, который без лечения приводит к летальному исходу.
- 79. При низкой концентрации инсулина и высоком уровне энергообеспеченности клетки (↑АТФ, ↑ ацетил-КоА и ↑ NADH·Н+) этот
- 80. Цикл Кребса – центральный путь обмена веществ. Своё название этот метаболический путь получил по имени открывшего
- 82. Эффект Пастера –подавление гликолиза дыханием впервые было обнаружено у микроорганизмов. Эффект Кретбри- преобладание анаэробного гликолиза, например
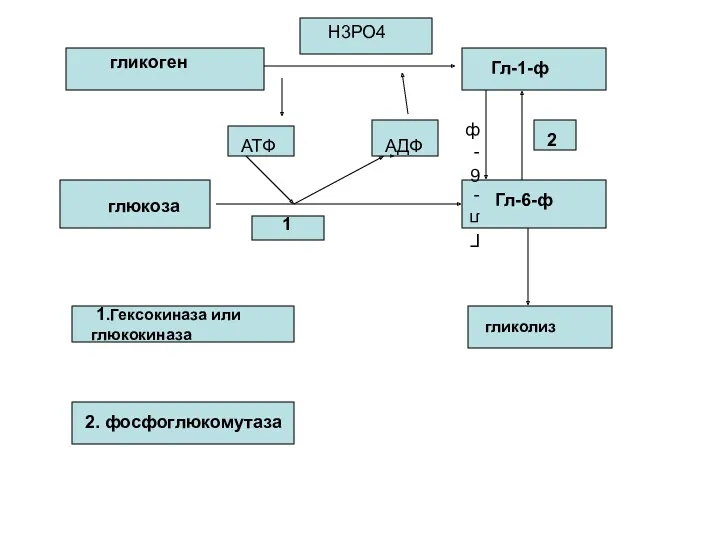
- 83. Гликогенолиз и гликолиз Процесс анаэробного распада гликогена получил название гликогенолиза. Образовавшийся в ходе фосфоглюкомутазной реакции Гл-6-ф,
- 84. гликоген Н3РО4 Гл-1-ф глюкоза Гл-6-ф Гл-6-ф АТФ АДФ 1 2 1.Гексокиназа или глюкокиназа 2. фосфоглюкомутаза гликолиз
- 85. В процессе гликогенолиза в виде макроэргических соединений накапливается не две, а три молекулы АТФ, т.к. не
- 87. Скачать презентацию










![Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232180/slide-18.jpg)




![На следующей стадии (катализируемой фосфоглицераткиназой [7]), гидролиз этого соединения сопряжен](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232180/slide-25.jpg)

![Далее происходит отщепление воды (фермент: енолаза [9]). Продукт представляет собой](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232180/slide-29.jpg)
![На последней стадии, которая катализируется пируваткиназой [10], образуются пируват и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232180/slide-31.jpg)















![Дальнейшее окисление ацетальдегида: HSKoA CН3СОН-----------?СН3СО SКоА---?ЦТК ↓[O] ↓ СН3СООН Н](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232180/slide-53.jpg)
























 Figure
Figure Радиоактивные элементы почв
Радиоактивные элементы почв Янгишиева
Янгишиева Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Омыватель лобового стекла
Омыватель лобового стекла Хімічні властивості кислот
Хімічні властивості кислот Фенолы
Фенолы Хімічна рівновага. Принцип зміщення хімічної рівноваги
Хімічна рівновага. Принцип зміщення хімічної рівноваги Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Ароматические углеводороды. 10 класс
Ароматические углеводороды. 10 класс Электронное и пространственное строение молекул органических соединений – основа их биологической активности
Электронное и пространственное строение молекул органических соединений – основа их биологической активности Кристаллофизика_часть_1
Кристаллофизика_часть_1 Сплав золота и серебра - электрум
Сплав золота и серебра - электрум Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Сірке қышқылын алу технологиясы
Сірке қышқылын алу технологиясы Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Теория электролитической диссоциации
Теория электролитической диссоциации Уравнения химических реакций
Уравнения химических реакций Лекарства дома
Лекарства дома Таблица элементов
Таблица элементов Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Химические свойства оксидов
Химические свойства оксидов Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ
Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы