Содержание
- 2. РЕШЕНИЕ: 1. В чём различие химических свойств многоатомных и одноатомных спиртов? Для спиртов характерны как основные,
- 3. РЕШЕНИЕ: 2. Водный раствор этиленгликоля с массовой долей 50% применяется в качестве антифриза для охлаждения автомобильных
- 4. РЕШЕНИЕ: 3. Запишите уравнения реакций по цепочке: ацетилен → этилен → этиленгликоль → → гликолят меди
- 5. Фенолы
- 6. В 1834 году Фридлиб Фердинанд Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с
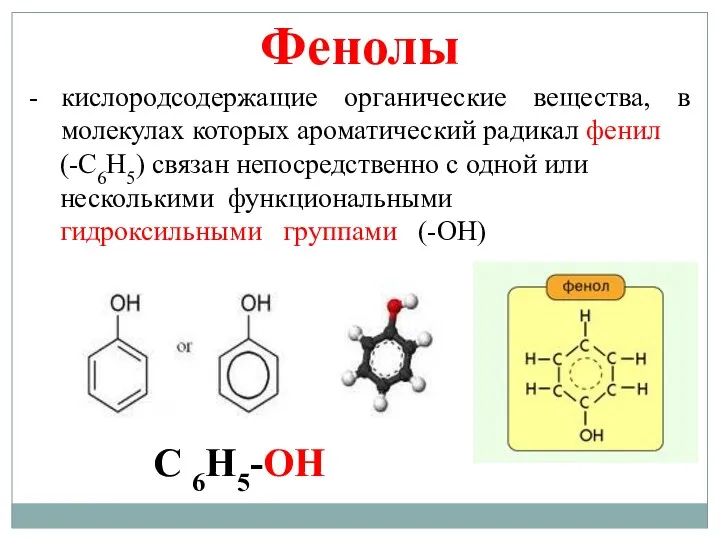
- 7. Фенолы кислородсодержащие органические вещества, в молекулах которых ароматический радикал фенил (-С6Н5) связан непосредственно с одной или
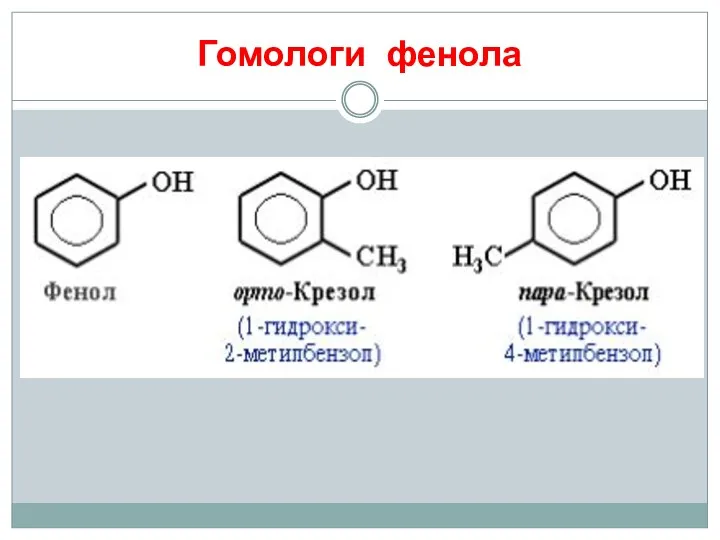
- 9. Гомологи фенола
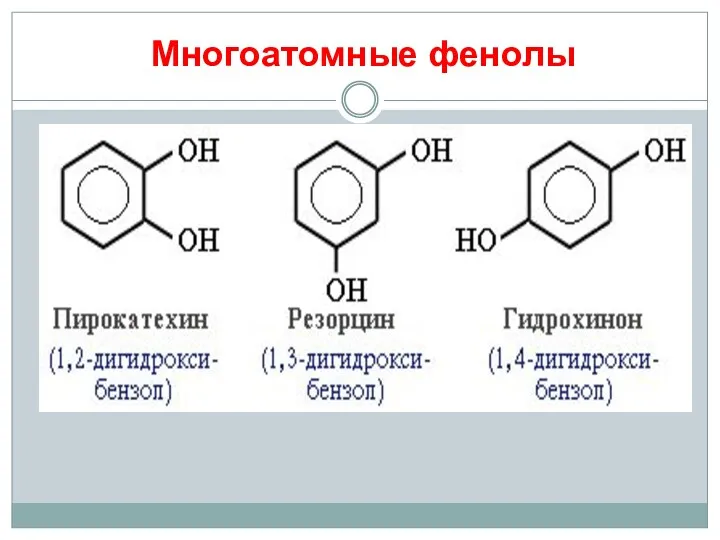
- 10. Многоатомные фенолы
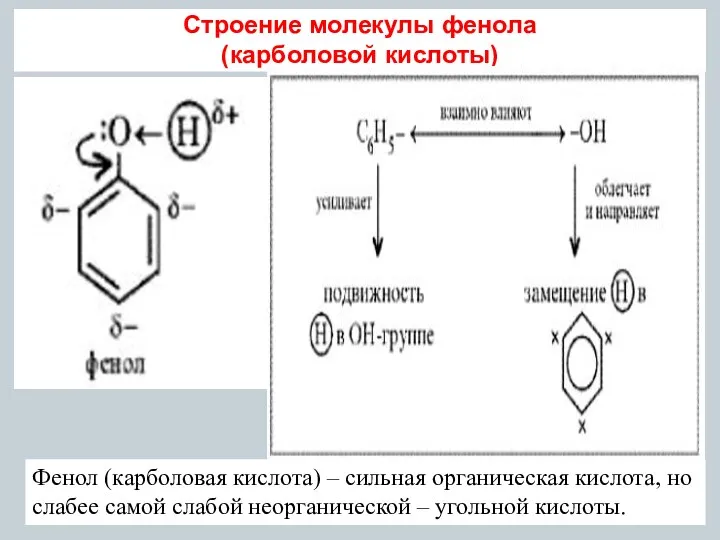
- 11. Строение молекулы фенола (карболовой кислоты) Фенол (карболовая кислота) – сильная органическая кислота, но слабее самой слабой
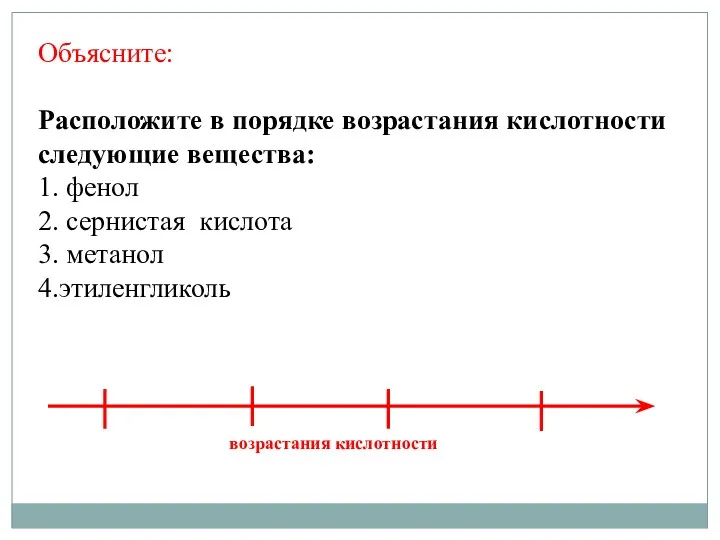
- 12. Объясните: Расположите в порядке возрастания кислотности следующие вещества: 1. фенол 2. сернистая кислота 3. метанол 4.этиленгликоль
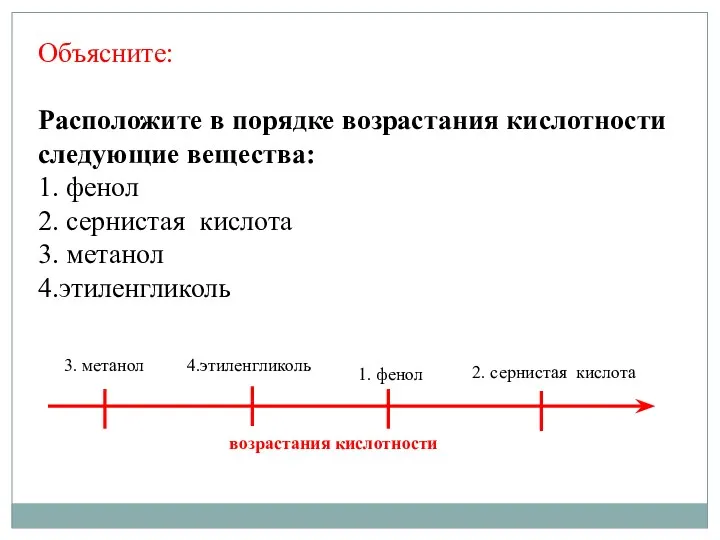
- 13. Объясните: Расположите в порядке возрастания кислотности следующие вещества: 1. фенол 2. сернистая кислота 3. метанол 4.этиленгликоль
- 14. Физические свойства фенола (карболовой кислоты) Игольчатые белые кристаллы с характерным запахом (похож на запах гуаши). Розовеет
- 15. Фенол (класс опасности – II) – сильный яд, оказывает общетоксическое действие, может всасываться в организм человека
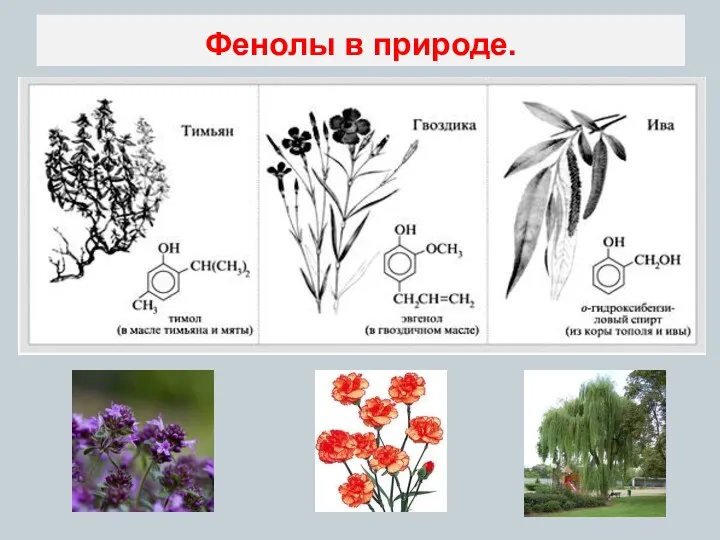
- 16. Фенолы в природе.
- 17. Способы получения фенола 1. Коксование каменного угля При нагревании угля до 1000о без доступа воздуха, получают
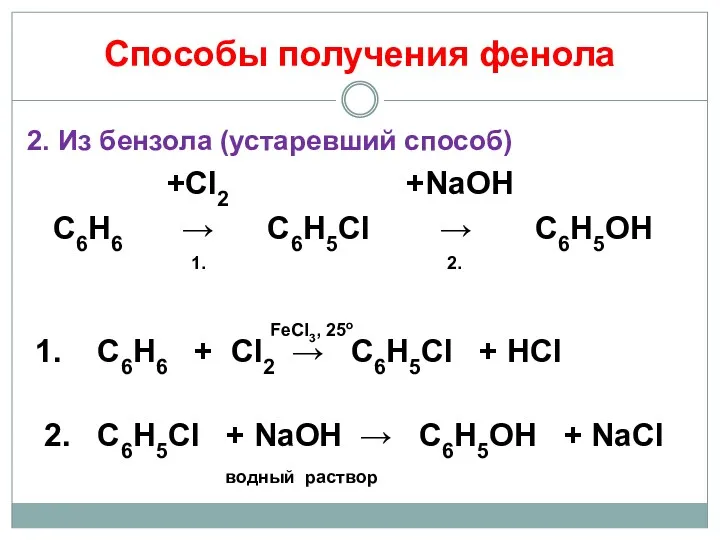
- 18. Способы получения фенола 2. Из бензола (устаревший способ) +Cl2 +NaOH С6Н6 → С6Н5Сl → С6Н5OH 1.
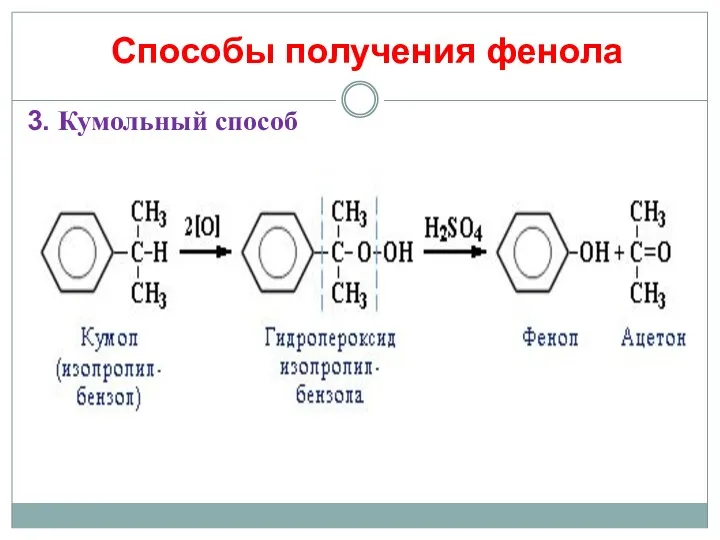
- 19. Способы получения фенола 3. Кумольный способ
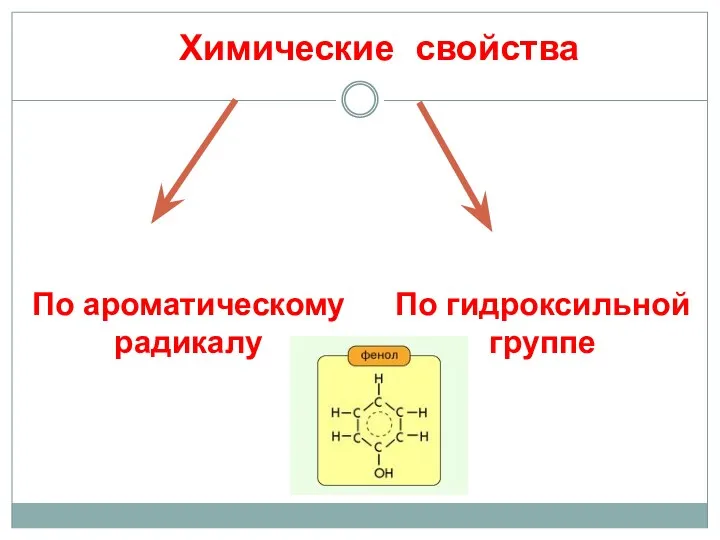
- 20. Химические свойства По ароматическому радикалу По гидроксильной группе
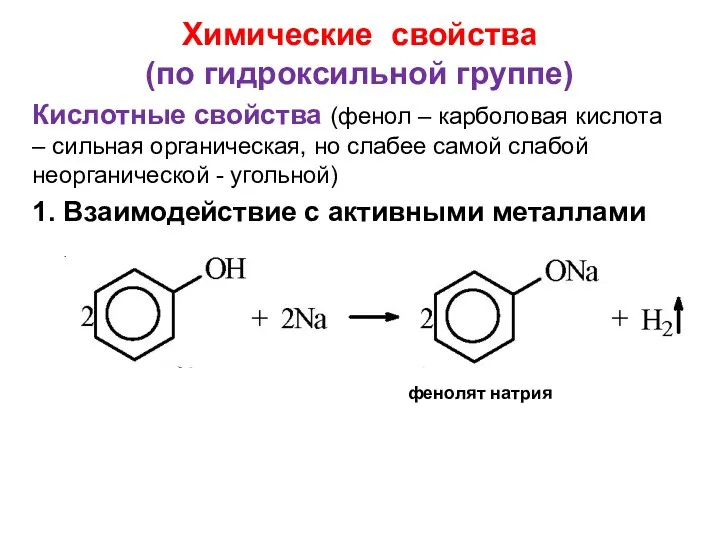
- 21. Химические свойства (по гидроксильной группе) Кислотные свойства (фенол – карболовая кислота – сильная органическая, но слабее
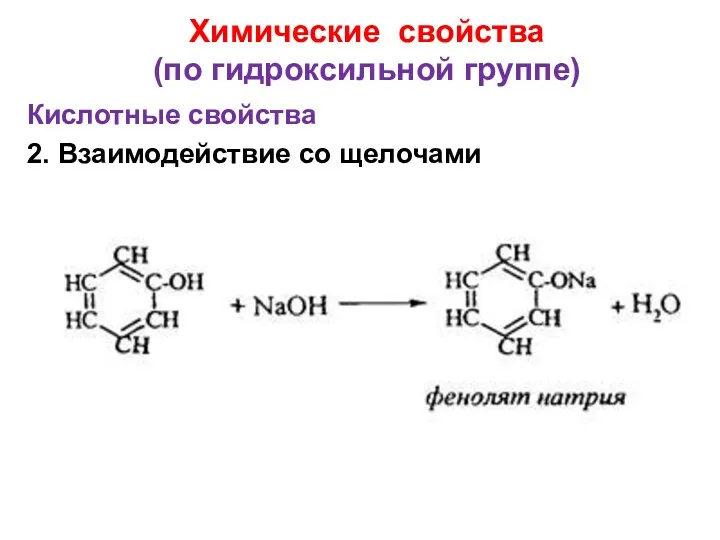
- 22. Химические свойства (по гидроксильной группе) Кислотные свойства 2. Взаимодействие со щелочами
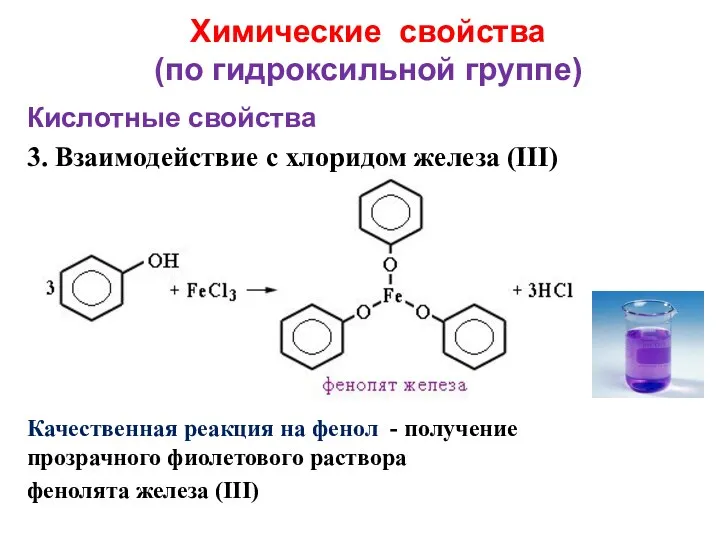
- 23. Химические свойства (по гидроксильной группе) Кислотные свойства 3. Взаимодействие с хлоридом железа (III) Качественная реакция на
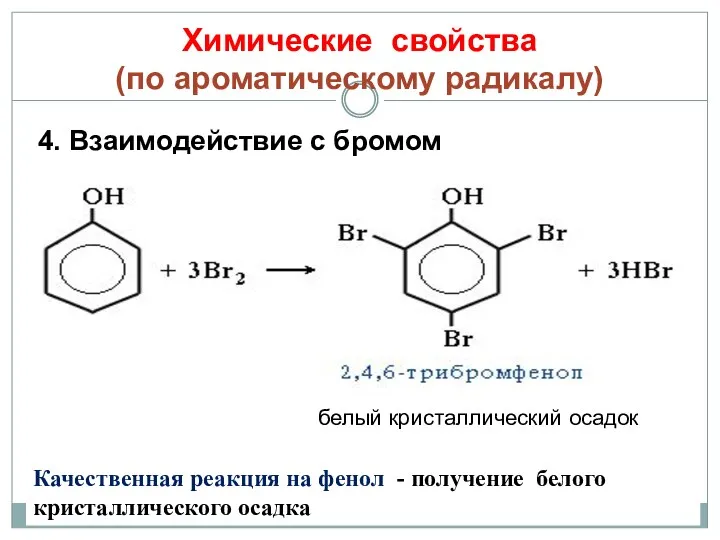
- 24. Химические свойства (по ароматическому радикалу) 4. Взаимодействие с бромом белый кристаллический осадок Качественная реакция на фенол
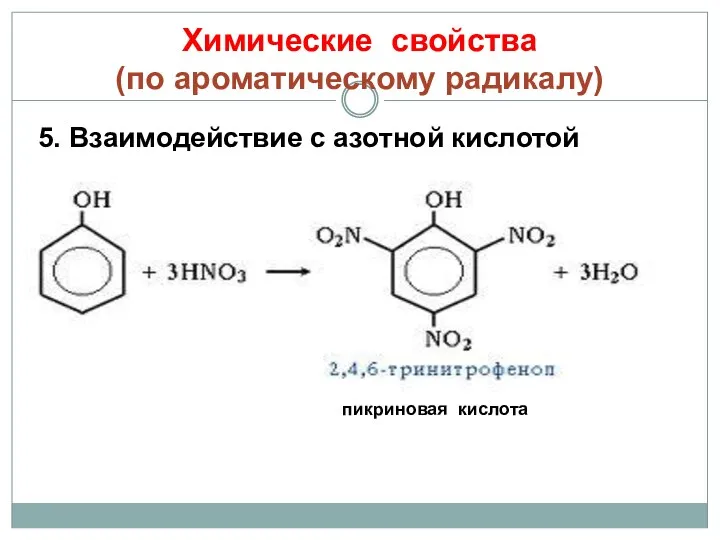
- 25. Химические свойства (по ароматическому радикалу) 5. Взаимодействие с азотной кислотой пикриновая кислота
- 26. ПИКРИНОВАЯ КИСЛОТА (тринитрофенол) кристаллы пикриновой кислоты горькие на вкус Тринитрофенол стал первым эффективным взрывчатым веществом. Взрывчатые
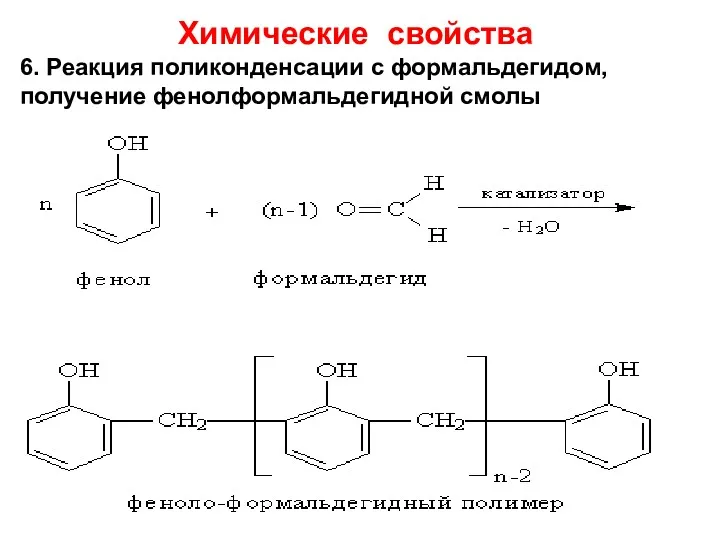
- 27. Химические свойства 6. Реакция поликонденсации с формальдегидом, получение фенолформальдегидной смолы
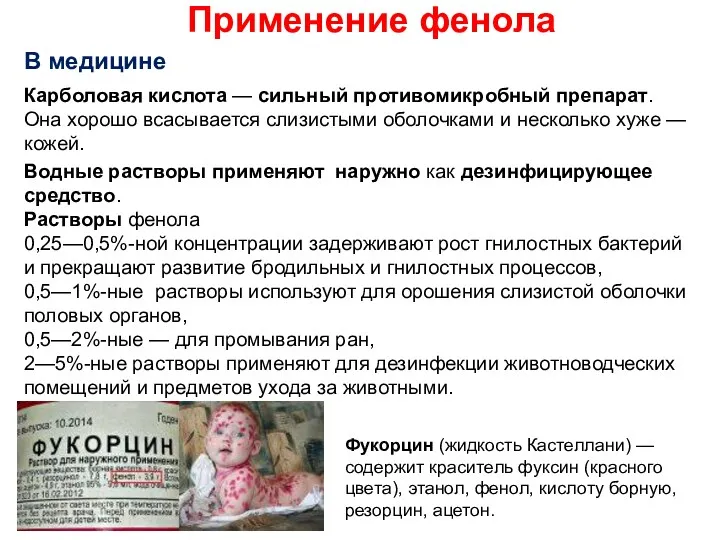
- 28. Применение фенола В медицине Карболовая кислота — сильный противомикробный препарат. Она хорошо всасывается слизистыми оболочками и
- 29. Применение фенола В медицине Глубокий химический пилинг. Из-за высокой токсичности фенола многие пластические хирурги используют феноловый
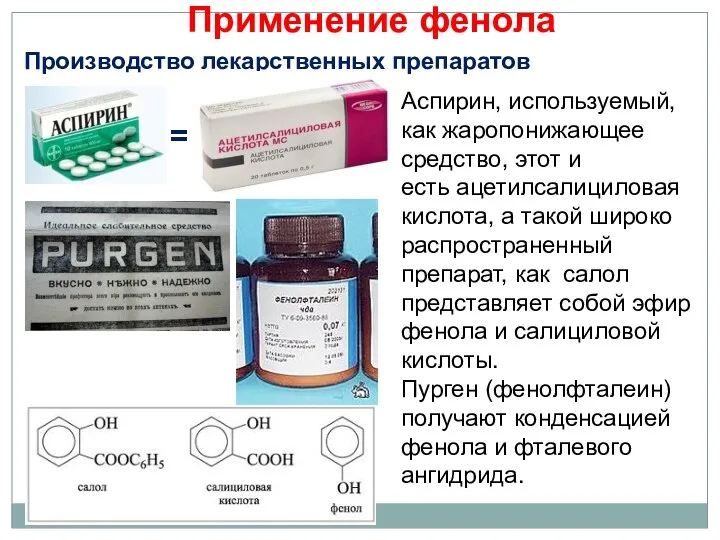
- 30. Применение фенола Производство лекарственных препаратов = Аспирин, используемый, как жаропонижающее средство, этот и есть ацетилсалициловая кислота,
- 31. Применение фенола Производство синтетических волокон - капрона и нейлона НЕЙЛОН КАПРОН «-» прочность снижается при попадании
- 32. Применение фенола Производство фенол-формальдегидных смол. Фенол-формальдегидная смола (формула [-C6H3(OH)-CH2-]n) имеет высокую электроизоляционность, хорошую коррозионную и механическую
- 33. Экологические проблемы производства
- 34. Главный виновник выбросов формальдегида и фенола. – процесс горения различных видов топлива. Например, лесные пожары, выхлопные
- 35. Решите задачи: Сколько граммов фенола было в реакционной смеси, если при действии бромной воды получилось 24,7
- 37. Скачать презентацию










![Применение фенола Производство фенол-формальдегидных смол. Фенол-формальдегидная смола (формула [-C6H3(OH)-CH2-]n) имеет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310196/slide-31.jpg)



 Элемент V группы фосфор
Элемент V группы фосфор Первичная переработка нефти
Первичная переработка нефти Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Железо
Железо Основные классы неорганических соединений
Основные классы неорганических соединений Нуклеопротеины
Нуклеопротеины Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Реакции ионного обмена
Реакции ионного обмена Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Алкалоиды, производные тропана
Алкалоиды, производные тропана Титриметрический метод анализа
Титриметрический метод анализа Figure
Figure Урок 25
Урок 25 Лекция 8.3. Реакции окисления и восстановления органических соединений
Лекция 8.3. Реакции окисления и восстановления органических соединений Халькогены. Кислород
Халькогены. Кислород Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Кристаллические решетки
Кристаллические решетки Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химическая связь
Химическая связь Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Методика изучения современной теории строения как фундамента курса органической химии в старшей школе
Методика изучения современной теории строения как фундамента курса органической химии в старшей школе Производные пиримидина
Производные пиримидина Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов