Слайд 2

Титрование смесей протолитов
До начала титрования:
2. До ТЭ:
Слайд 3

Титрование смесей протолитов
3. В первой ТЭ:
4. После первой ТЭ:
Слайд 4

Титрование смесей протолитов
3. Во второй ТЭ:
4. После второй ТЭ:
рН = 14
– рОН.
Слайд 5

Ионная теория
HInd ↔ H+ + Ind-
Слайд 6

Протолитическая теория
HInd + Н2О↔ H3О+ + Ind-
Слайд 7
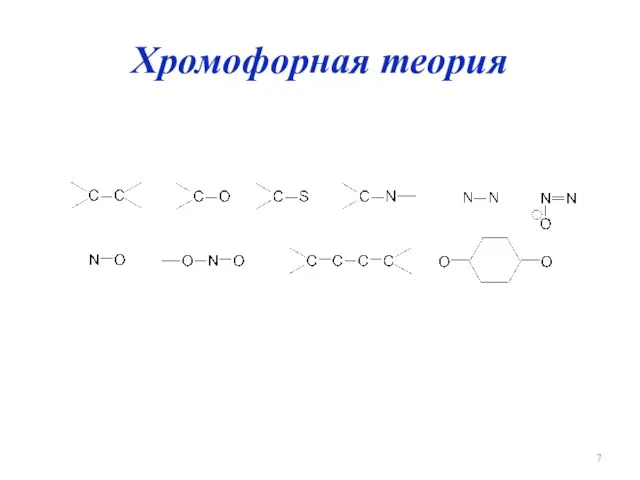
Слайд 8

Хромофоры
Таутомеры
Ауксохромы:
Hal-, –CH3, –OH, –OCH3, –NH2,
–NHCH3, –N(CH3)2
Слайд 9

Требования к индикаторам
I. Индикатор должен обладать высоким светопоглощением, чтобы окраска даже
его небольшого количества (СInd = 10-5 – 10-4 моль/л) была заметна для человеческого глаза. Большие концентрации индикатора могут привести к заметному расходу на него титранта.
II. Переход окраски должен быть контрастным.
III. Область перехода окраски должна быть как можно ýже.
IV. Изменение цвета индикатора должно происходить резко. Количество протолита, необходимое для изменения цвета индикатора должно быть настолько мало, чтобы не искажать результаты титрования.
V. Изменение цвета индикатора должно быть обратимым.
Слайд 10

Слайд 11
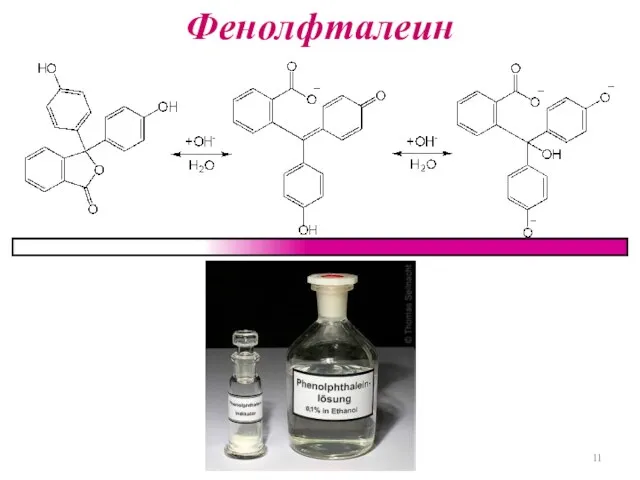
Слайд 12

Равновесие в растворе индикатора
HInd + H2O ↔ Ind- + H3O+
Слайд 13
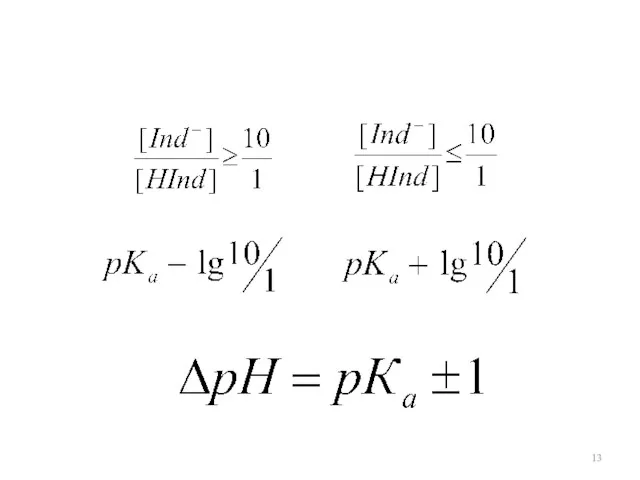
Слайд 14

Для одноцветного индикатора
Слайд 15

Показатель титрования
рТ – показатель титрования
рН = рКа
Слайд 16
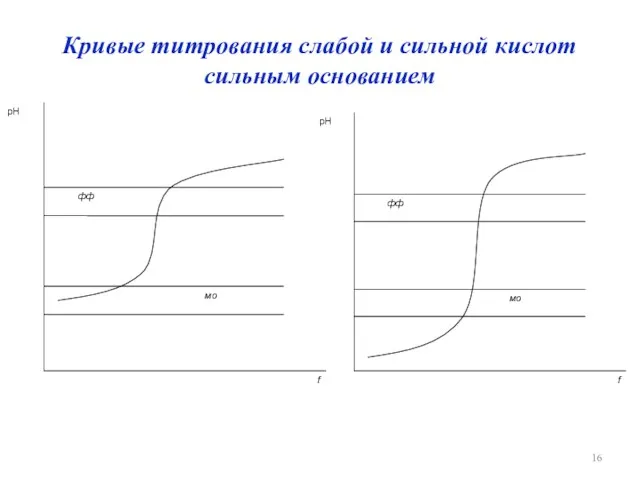
Кривые титрования слабой и сильной кислот сильным основанием
Слайд 17

Индикаторные погрешности
Оценка индикаторной погрешности:
Графический вариант;
Расчетный способ.
Избыток титранта – ошибка положительная
Избыток титруемого
вещества – ошибка отрицательная
Слайд 18

Водородная (гидроксониевая) ошибка
1. Если сильная кислота титруется сильным основанием и рТ
< рНТЭ
2. Если сильное основание титруется сильной кислотой и рТ > рНТЭ
3. Если слабое основание титруется сильной кислотой и рТ > рНТЭ
Слайд 19

Водородная (гидроксониевая) ошибка
Слайд 20

Гидроксильная ошибка
1. Если сильная кислота титруется сильным основанием и рТ >
рНТЭ
2. Если сильное основание титруется сильной кислотой и рТ < рНТЭ
3. Если слабая кислота титруется сильным основанием и рТ > рНТЭ
Слайд 21

Слайд 22

Кислотная или НА-ошибка
Если слабая кислота титруется сильным основанием и рТ
< рНТЭ
Слайд 23

Слайд 24

Основная или В-ошибка
Если слабое основание титруется сильной кислотой и рТ
> рНТЭ











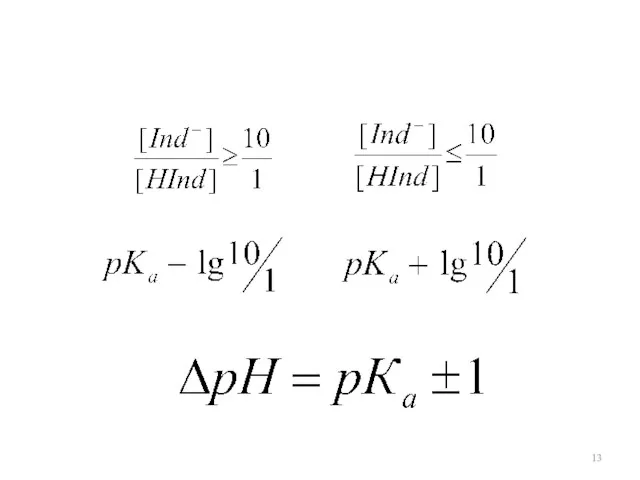











 Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Аминокислоты. Что нужно для настоящего атлета?
Аминокислоты. Что нужно для настоящего атлета? Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Строение и свойства циклоалканов
Строение и свойства циклоалканов ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ Алкани, насичені вуглеводні
Алкани, насичені вуглеводні Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Теория строения органических веществ А.М. Бутлеров
Теория строения органических веществ А.М. Бутлеров Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Химическая связь и строение химических соединений
Химическая связь и строение химических соединений Установка по переработке углеводородов
Установка по переработке углеводородов Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Водород. Урок химии
Водород. Урок химии Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Темір. Жай заттармен
Темір. Жай заттармен Дисперсные системы
Дисперсные системы Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Серебро. История
Серебро. История Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Полистирол өндірісі
Полистирол өндірісі