Содержание
- 2. ВАЖНЕЙШИЕ ПОНЯТИЯ 1. Химической связью называется совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов
- 3. ВИДЫ И ТЕОРИИ ХИМИЧЕСКОЙ СВЯЗИ Различают следующие основные виды связей: ковалентная, ионная, металлическая и водородная. Природа
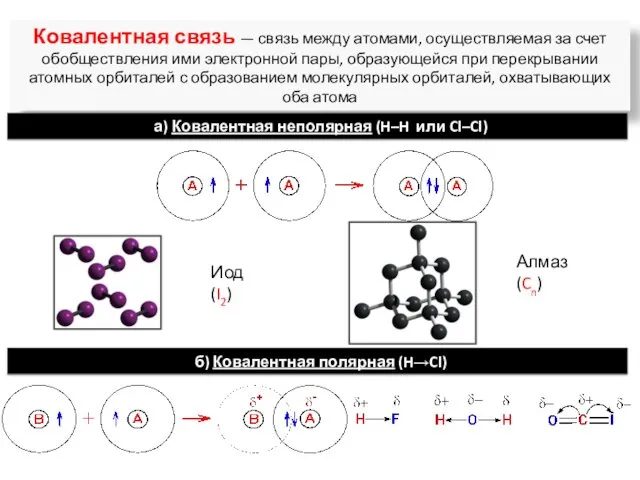
- 4. Ковалентная связь — связь между атомами, осуществляемая за счет обобществления ими электронной пары, образующейся при перекрывании
- 5. Полярность связи Полярность связи количественно оценивается дипольным моментом : μ = lq , где q -
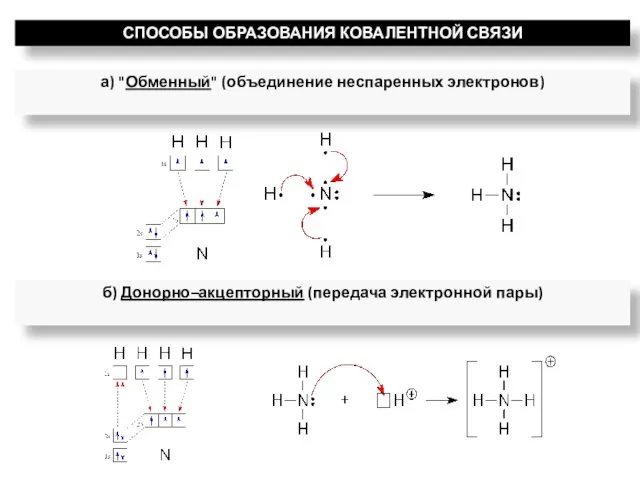
- 6. СПОСОБЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ а) "Обменный" (объединение неспаренных электронов) б) Донорно–акцепторный (передача электронной пары)
- 7. Свойства ковалентной связи: 1. Длина связи – расстояние между ядрами атомов в молекуле (нм – 10-9
- 8. Свойства ковалентной связи 3. Насыщаемость связи – способность атомов образовывать ограниченное число ковалентных связей. Благодаря насыщаемости
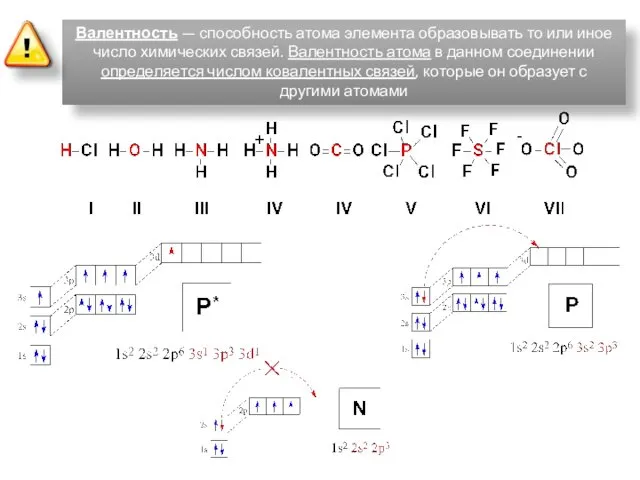
- 9. Валентность — способность атома элемента образовывать то или иное число химических связей. Валентность атома в данном
- 10. ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ АТОМА ОПРЕДЕЛЯЮТСЯ: 1) Числом неспаренных электронов в основном или возбужденном состояниях
- 11. 2) Числом неподеленных пар электронов или вакантных орбиталей, способных участвовать в образовании связей по донорно-акцепторному механизму
- 12. Свойства ковалентной связи 4. Ковалентная связь возникает в направлении максимального перекрывания орбиталей. По степени перекрывания различают
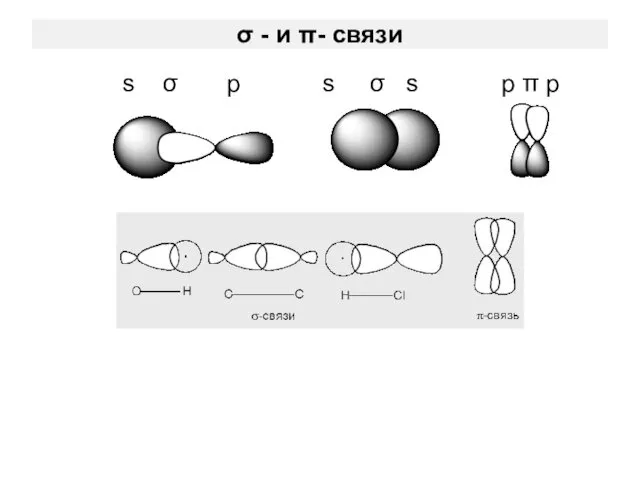
- 13. σ - и π- связи s σ p s σ s p π p
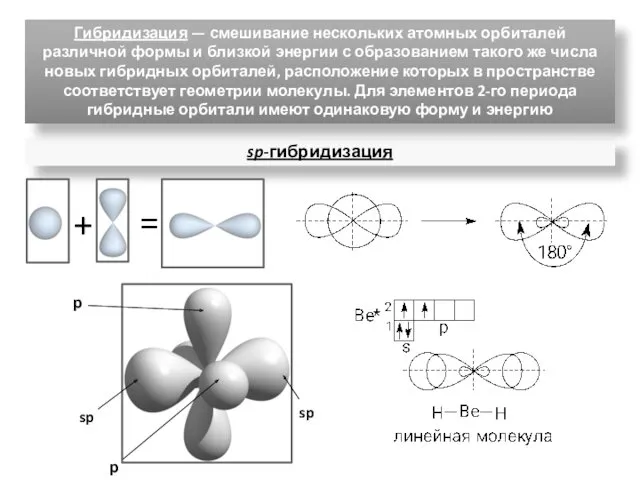
- 14. sp-гибридизация Гибридизация — смешивание нескольких атомных орбиталей различной формы и близкой энергии с образованием такого же
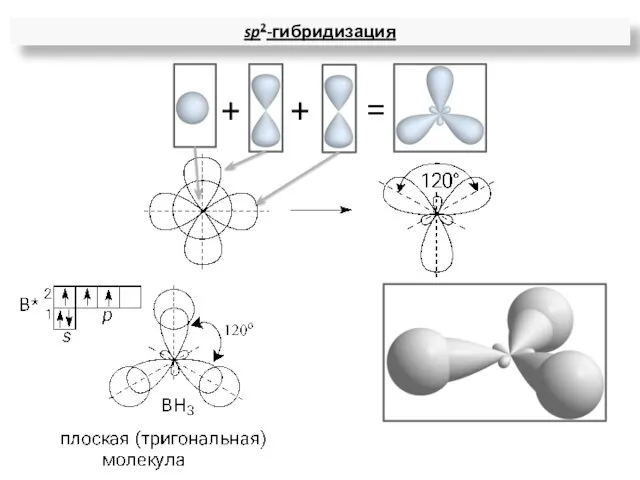
- 15. sp2-гибридизация = + +
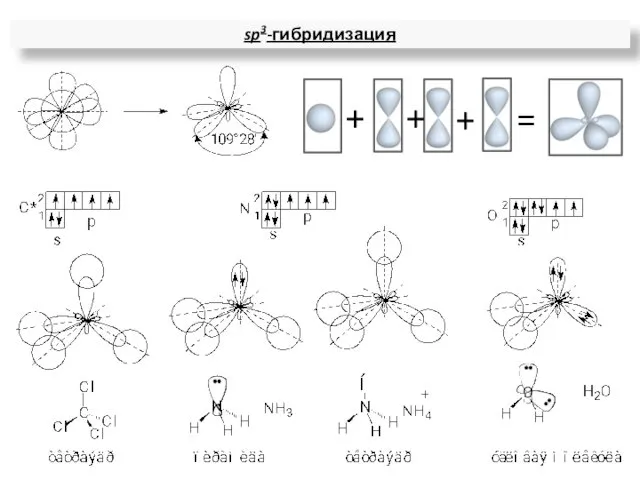
- 16. sp3-гибридизация = + + +
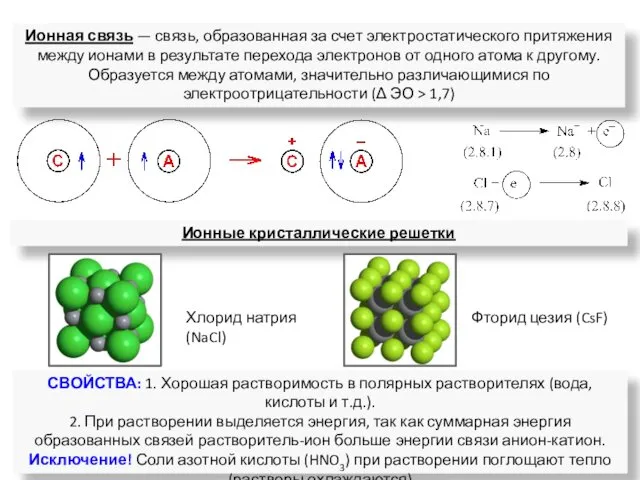
- 17. Ионные кристаллические решетки Фторид цезия (CsF) Ионная связь — связь, образованная за счет электростатического притяжения между
- 18. Ионная связь Соединения, которые образовались из ионов, называют гетерополярными или ионными. Пример образования ионной связи: 11Na
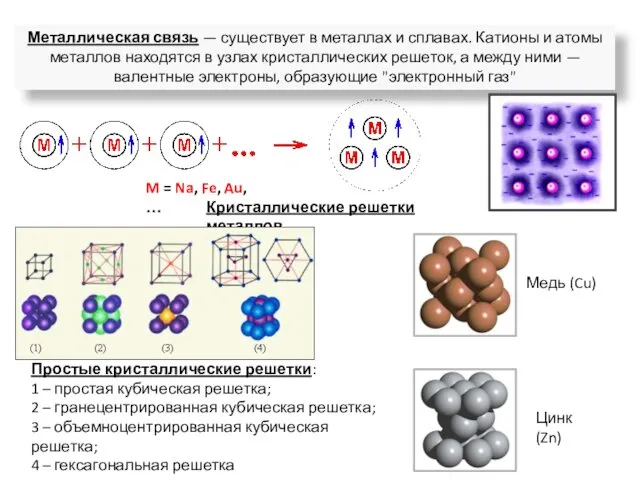
- 19. Кристаллические решетки металлов Медь (Cu) M = Na, Fe, Au, … Металлическая связь — существует в
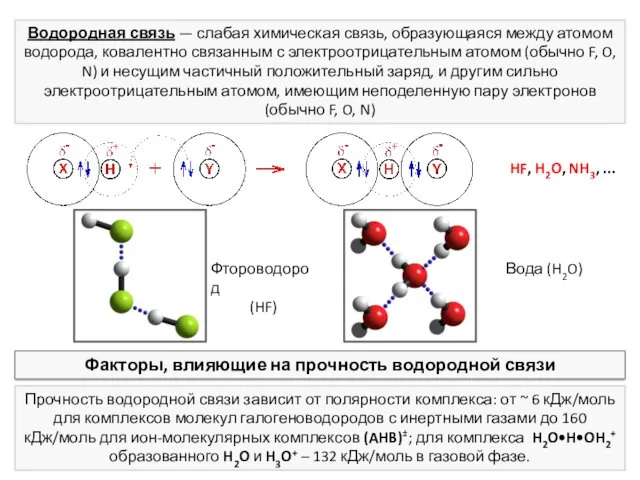
- 20. Вода (H2O) HF, H2O, NH3, ... Водородная связь — слабая химическая связь, образующаяся между атомом водорода,
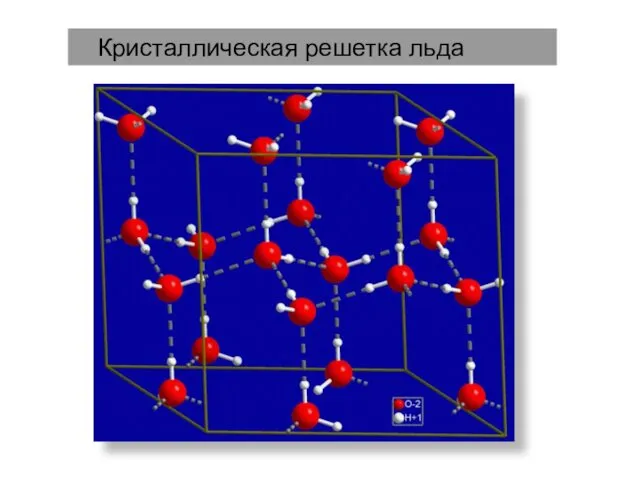
- 21. Кристаллическая решетка льда
- 22. Квантомеханические теории связи Математическая сущность теории состоит в построении молекулярных орбиталей на основе сложения или вычитания
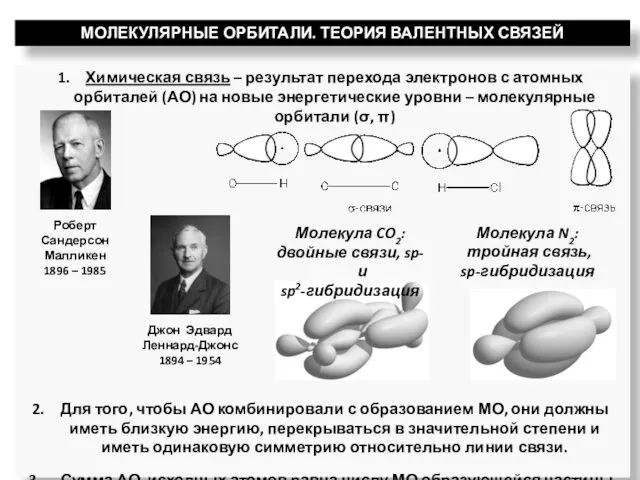
- 23. Химическая связь – результат перехода электронов с атомных орбиталей (АО) на новые энергетические уровни – молекулярные
- 24. 3. МО в большинстве случаев многоцентровые, т.к. частицы образованы двумя и более атомами. В первом приближении
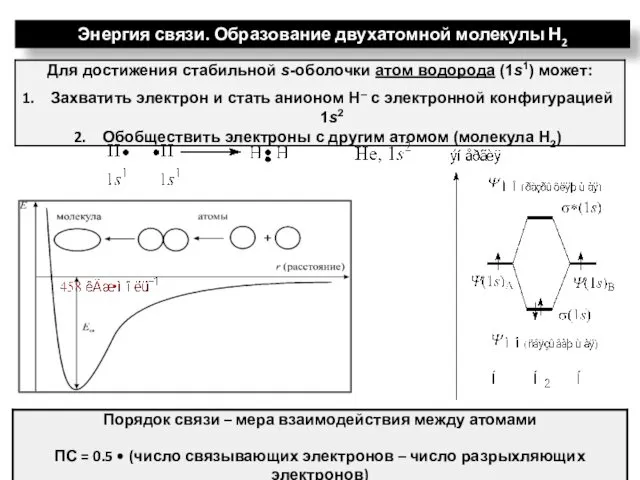
- 25. Энергия связи. Образование двухатомной молекулы Н2
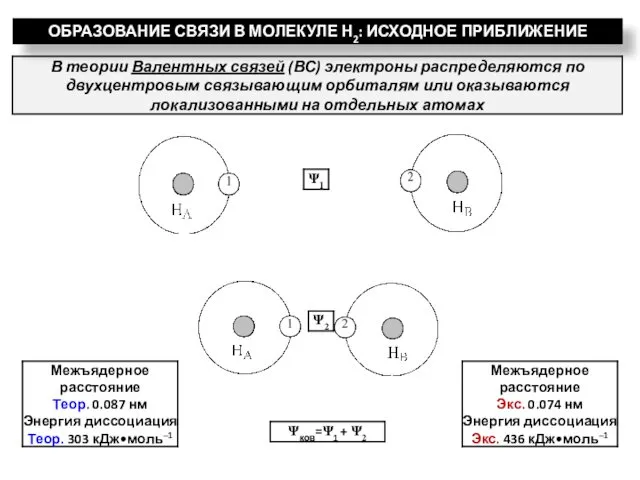
- 26. ОБРАЗОВАНИЕ СВЯЗИ В МОЛЕКУЛЕ Н2: ИСХОДНОЕ ПРИБЛИЖЕНИЕ
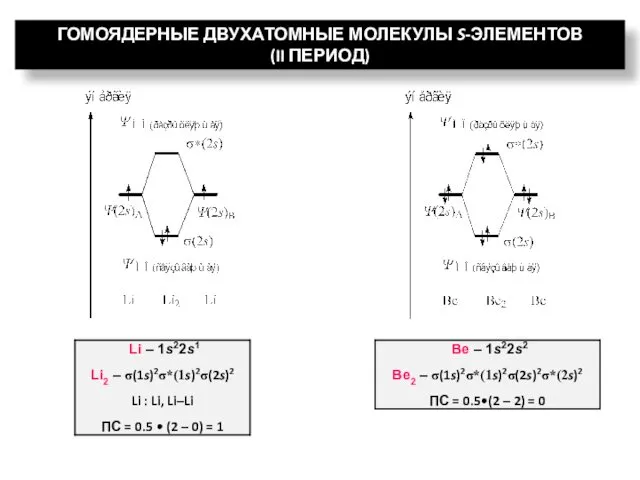
- 27. ГОМОЯДЕРНЫЕ ДВУХАТОМНЫЕ МОЛЕКУЛЫ S-ЭЛЕМЕНТОВ (II ПЕРИОД)
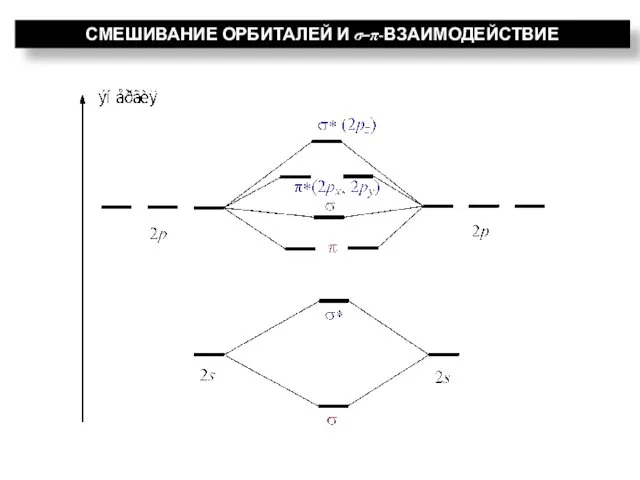
- 28. СМЕШИВАНИЕ ОРБИТАЛЕЙ И σ–π-ВЗАИМОДЕЙСТВИЕ
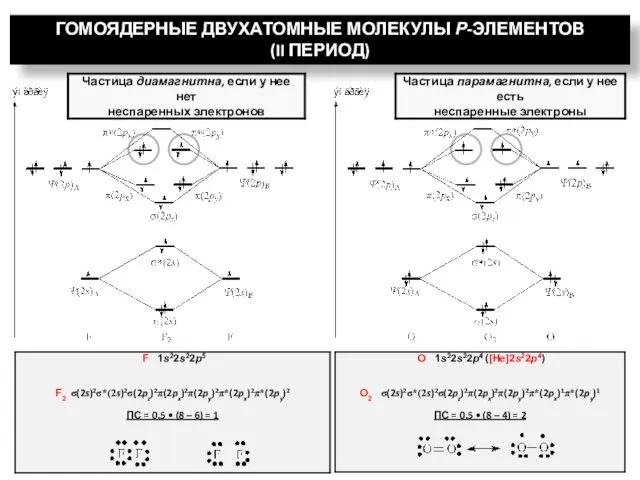
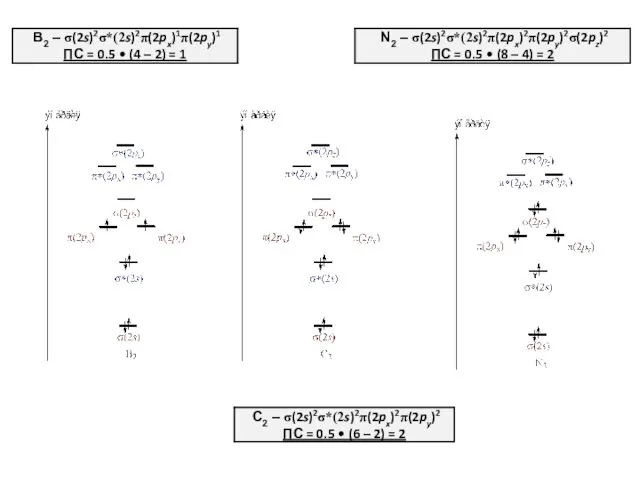
- 29. ГОМОЯДЕРНЫЕ ДВУХАТОМНЫЕ МОЛЕКУЛЫ Р-ЭЛЕМЕНТОВ (II ПЕРИОД)
- 33. КАКИЕ СВОЙСТВА МОЛЕКУЛЫ Н2 МОГУТ БЫТЬ ПРЕДСКАЗАНЫ ТЕОРИЕЙ ВАЛЕНТНЫХ СВЯЗЕЙ И МЕТОДОМ МО Структура Льюиса показывает,
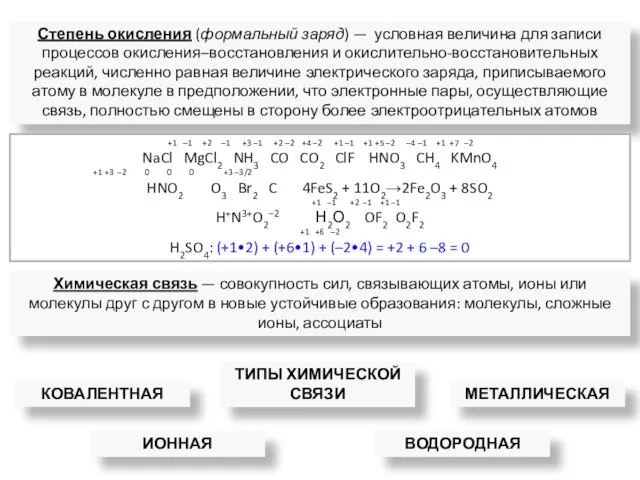
- 34. Химическая связь — совокупность сил, связывающих атомы, ионы или молекулы друг с другом в новые устойчивые
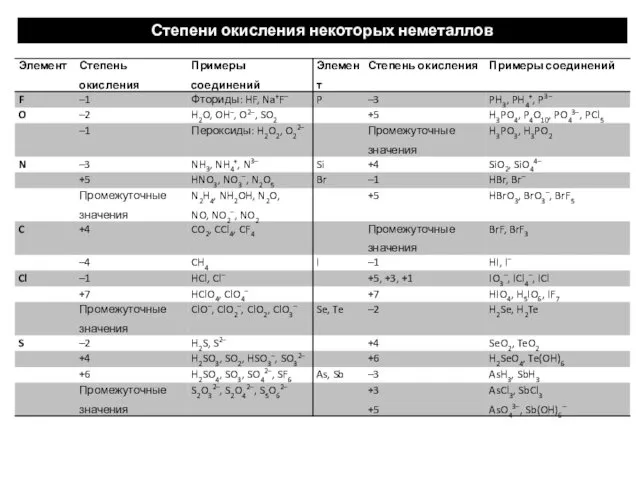
- 35. Степени окисления некоторых неметаллов
- 37. Скачать презентацию













 Electrochemistry
Electrochemistry Алюминий и его свойства
Алюминий и его свойства Комплексиметрическое титрование
Комплексиметрическое титрование Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Типы химических реакций
Типы химических реакций Алюминий. Химические свойства
Алюминий. Химические свойства Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Плавление и кристаллизация
Плавление и кристаллизация Металдар
Металдар Электоролиз заңы
Электоролиз заңы Химические свойства и получение алканов
Химические свойства и получение алканов Предмет и содержание фармацевтической и косметологической химии
Предмет и содержание фармацевтической и косметологической химии Газовая хроматография
Газовая хроматография Электроотрицательность. Ковалентная полярная связь. (Тема 12)
Электроотрицательность. Ковалентная полярная связь. (Тема 12) Тема 9 - Азотсодержащие и гетероциклические органические соединения
Тема 9 - Азотсодержащие и гетероциклические органические соединения Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Классификация органических соединений. Теория химического строения вещества. 10 класс
Классификация органических соединений. Теория химического строения вещества. 10 класс Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Введение в органическую химию
Введение в органическую химию Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Водород. Химические свойства
Водород. Химические свойства 20231012_metally.fizicheskie_svoystva
20231012_metally.fizicheskie_svoystva