Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка презентация
Содержание
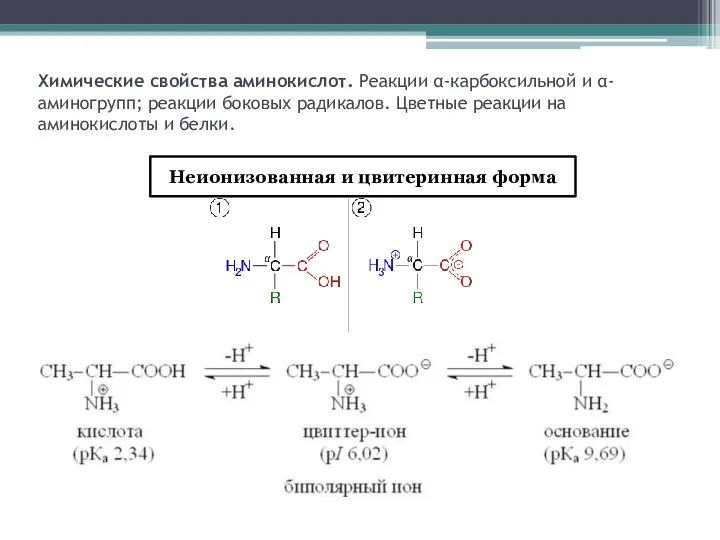
- 2. Химические свойства аминокислот. Реакции α-карбоксильной и α-аминогрупп; реакции боковых радикалов. Цветные реакции на аминокислоты и белки.
- 3. Изоэлектрическая точка Величина изоэлектрической точки амфотерной молекулы определяется величинами констант диссоциации кислотной и основной фракций: Метод
- 4. Изоэлектрофокусирование
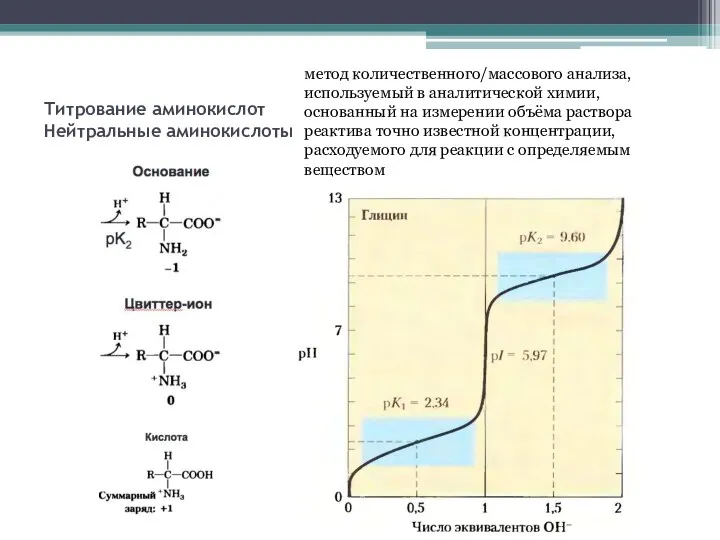
- 5. Титрование аминокислот Нейтральные аминокислоты метод количественного/массового анализа, используемый в аналитической химии, основанный на измерении объёма раствора
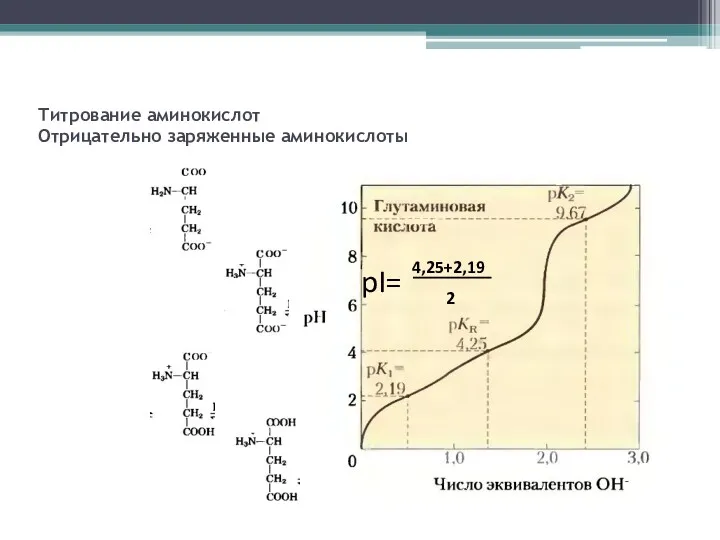
- 6. Титрование аминокислот Отрицательно заряженные аминокислоты 4,25+2,19 2 pI=
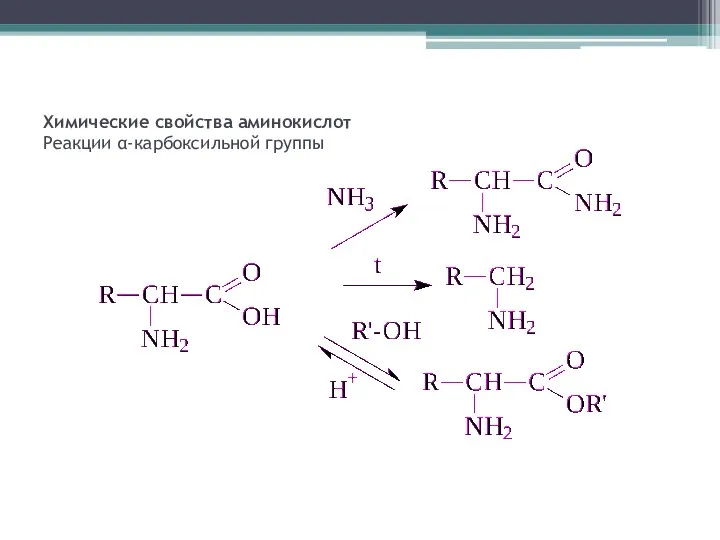
- 7. Химические свойства аминокислот Реакции α-карбоксильной группы
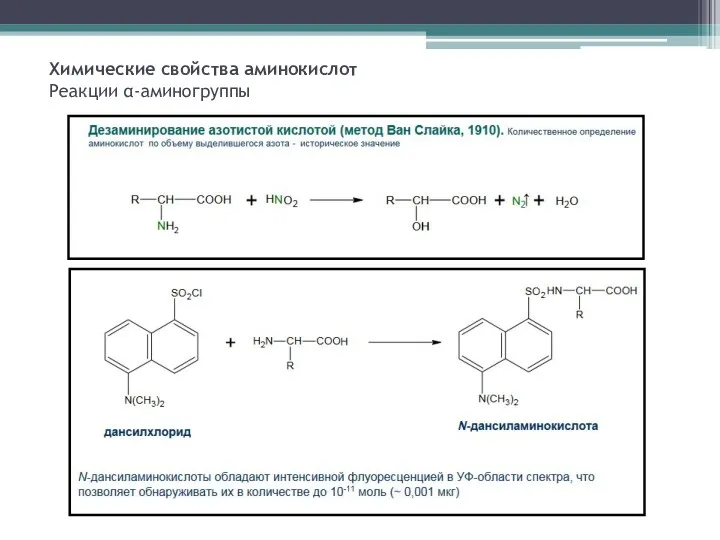
- 8. Химические свойства аминокислот Реакции α-аминогруппы
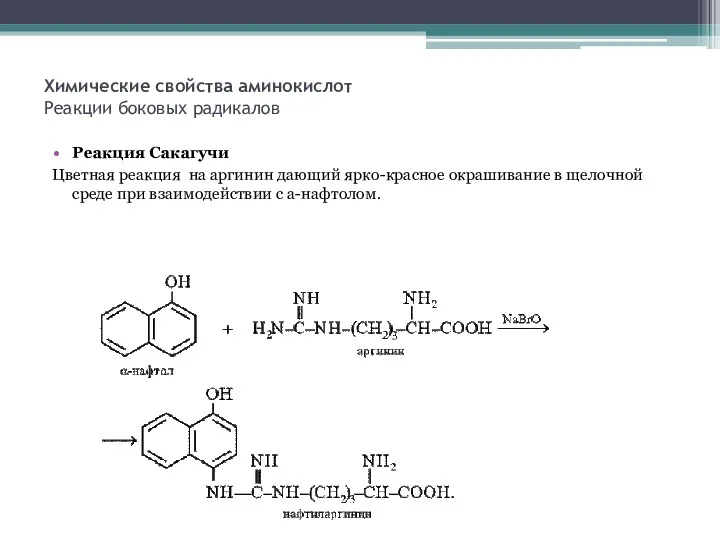
- 9. Химические свойства аминокислот Реакции боковых радикалов Реакция Сакагучи Цветная реакция на аргинин дающий ярко-красное окрашивание в
- 10. Химические свойства аминокислот Реакции боковых радикалов Реакция Фоля (Качественная реакция на цистин и аминокислоту цистеин)
- 11. Определение аминокислотной последовательности белков Методы основанные на последовательном отщеплении концевых аминокислот С N-конца Реагенты: Дансил хлорид
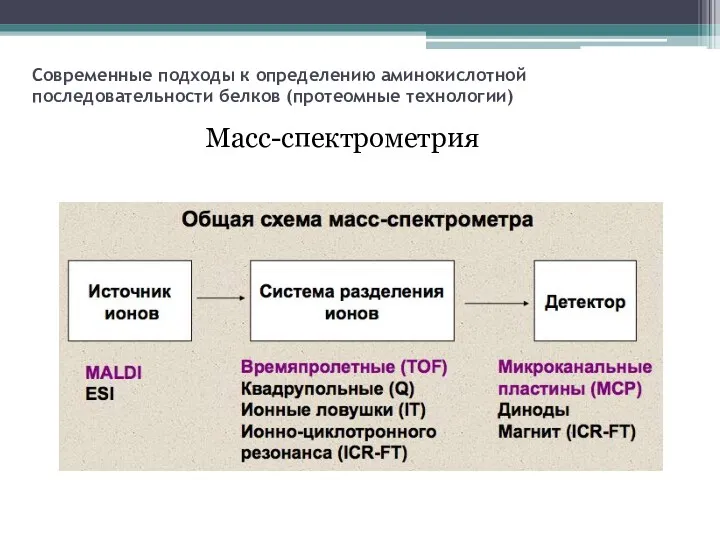
- 12. Современные подходы к определению аминокислотной последовательности белков (протеомные технологии) Масс-спектрометрия
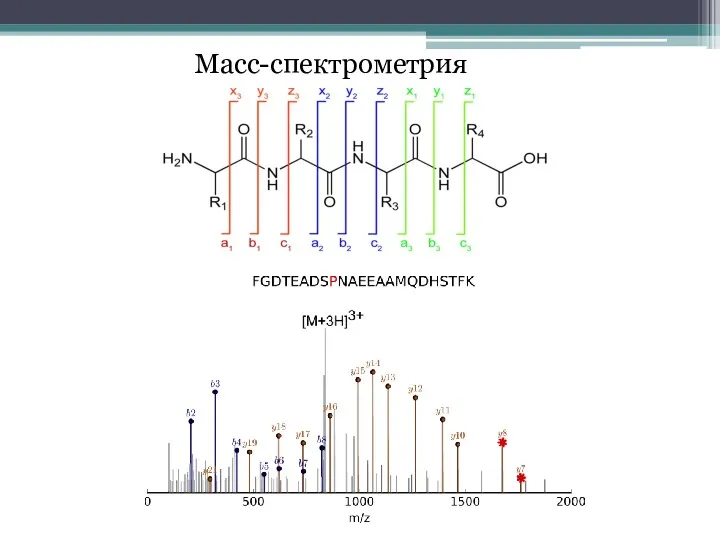
- 13. Масс-спектрометрия
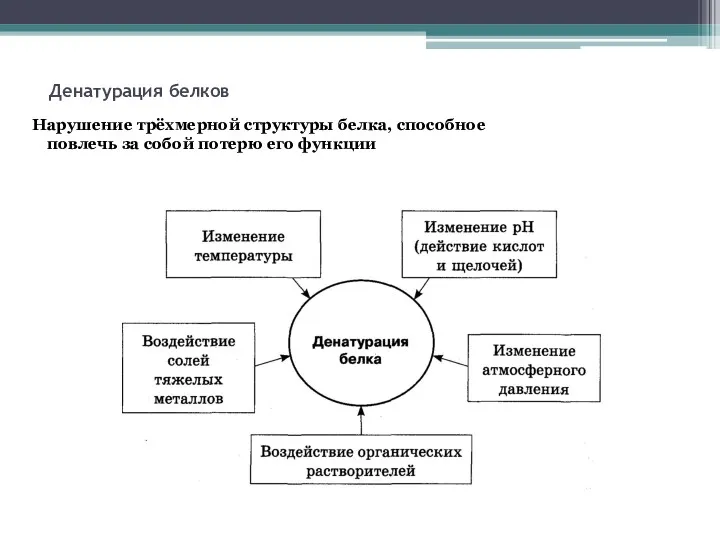
- 14. Денатурация белков Нарушение трёхмерной структуры белка, способное повлечь за собой потерю его функции
- 15. Денатурация белков (NH3)2SO4 HNO3 (конц.) ацетон Обратимая Необратимая Температурные воздействия Минеральные кислоты Органические растворители Нейтральные соли
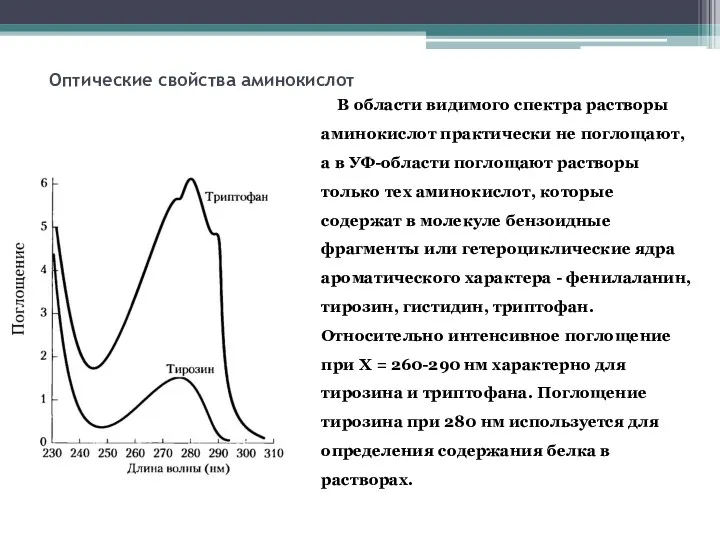
- 16. Оптические свойства аминокислот В области видимого спектра растворы аминокислот практически не поглощают, а в УФ-области поглощают
- 17. Закон Бугера-Ламберта-Бера I0 – интенсивность падающего на образец света I – интенсивность света после прохода через
- 18. Методы количественного определения белков. Спектрофотометрические и колориметрические методы определения концентрации белков. Колориметрия — физический метод химического
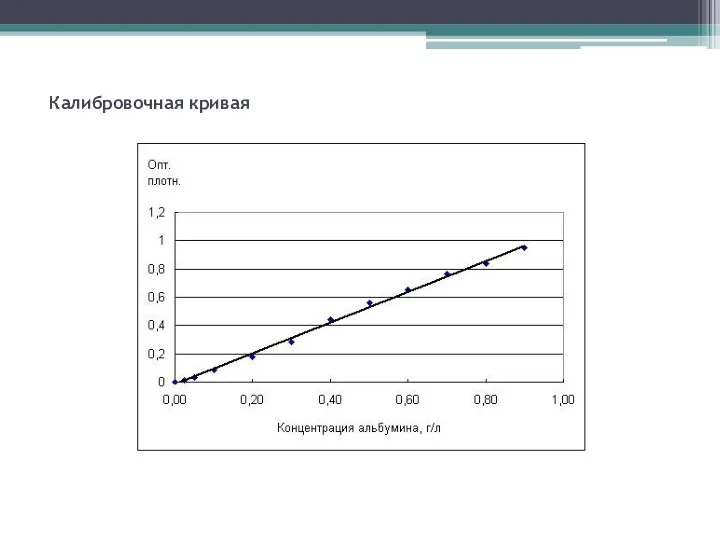
- 19. Калибровочная кривая
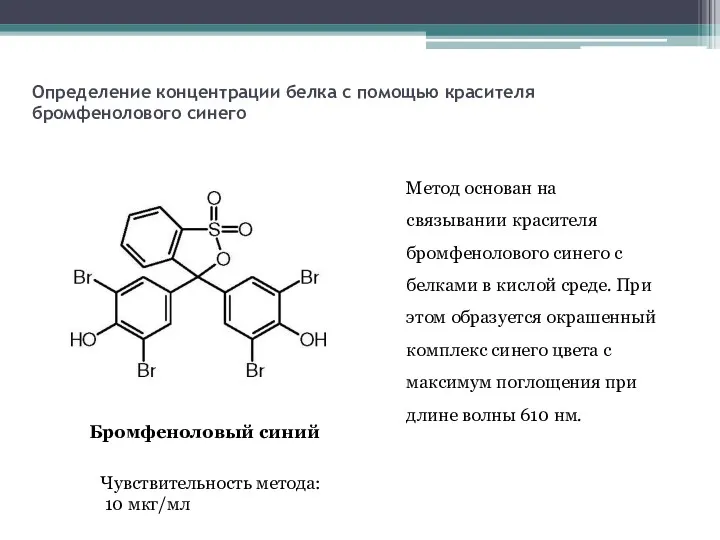
- 20. Определение концентрации белка с помощью красителя бромфенолового синего Бромфеноловый синий Чувствительность метода: 10 мкг/мл Метод основан
- 21. Биуретовый метод определения концентрации белка Образование в щелочной среде окрашенного в фиолетовый цвет комплекса пептидных связей
- 22. Определение концентрации белка по методу Лоури с применением реактива Фолина-Чокальтеу Чувствительность метода: 10-100 мкг белка В
- 23. Работа в лаборатории
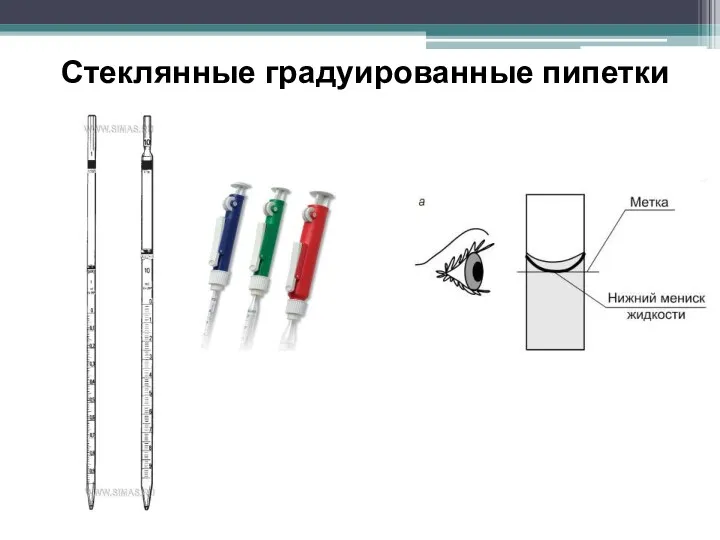
- 24. Стеклянные градуированные пипетки
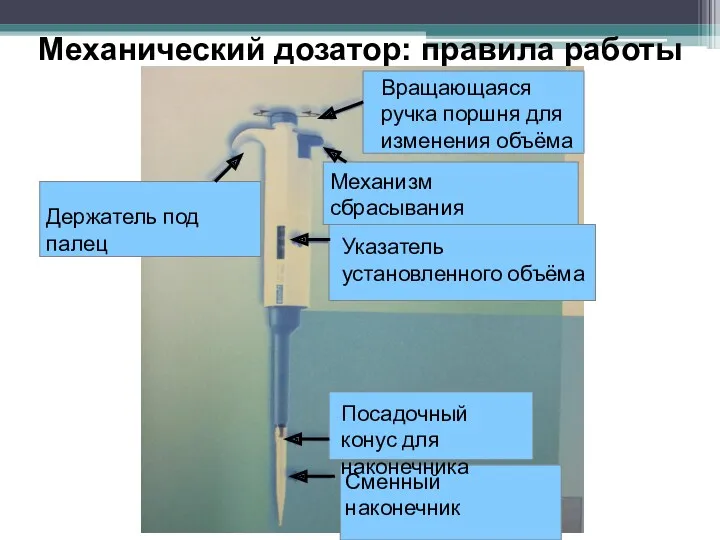
- 25. Механический дозатор: правила работы Сменный наконечник Держатель под палец Вращающаяся ручка поршня для изменения объёма Механизм
- 27. Скачать презентацию









 Оксиды. Химические свойства
Оксиды. Химические свойства Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие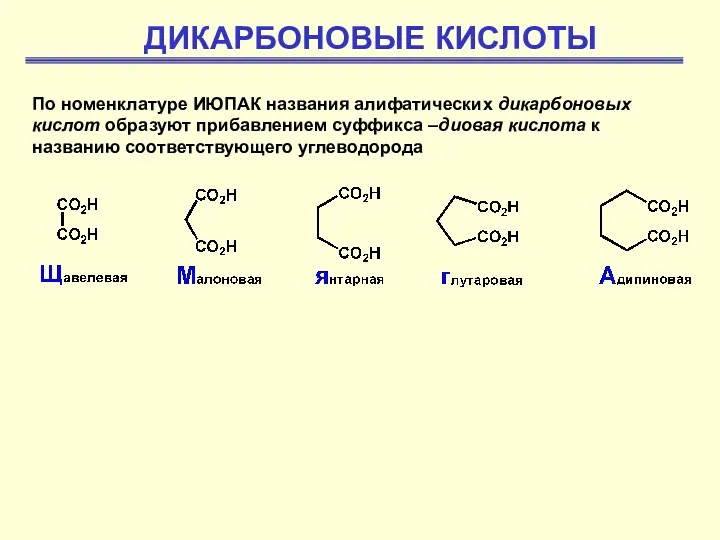 Дикарбоновые кислоты
Дикарбоновые кислоты Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Тайна мыльного пузыря
Тайна мыльного пузыря Облучение. Радиационная окраска
Облучение. Радиационная окраска Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Тұндыру әдістері
Тұндыру әдістері Сплавы и коррозия металлов
Сплавы и коррозия металлов Щелочные металлы
Щелочные металлы Уральские горы. Самоцветы
Уральские горы. Самоцветы Олимпиада по учебной дисциплине. Химия
Олимпиада по учебной дисциплине. Химия Кремний и его соединения. 9 класс
Кремний и его соединения. 9 класс Химическое образование в современной средней (полной) общеобразовательной школе
Химическое образование в современной средней (полной) общеобразовательной школе Непредельные углеводороды. Алкены (этиленовые углеводороды)
Непредельные углеводороды. Алкены (этиленовые углеводороды) Етилен і ацетилен – ненасичені вуглеводні
Етилен і ацетилен – ненасичені вуглеводні Химия нефти и газа
Химия нефти и газа Строение атома
Строение атома Особенности органических веществ. 9 класс
Особенности органических веществ. 9 класс Глоссарий
Глоссарий Производные фурана, пиррола, тиофена
Производные фурана, пиррола, тиофена Хімічні властивості металів
Хімічні властивості металів Крахмал. Строение вещества
Крахмал. Строение вещества Күрделі белоктар
Күрделі белоктар Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)
Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2) Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов Основные химические понятия
Основные химические понятия