Содержание
- 2. Щоб пізнати – треба навчитися спостерігати
- 3. Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (подвійні – С =
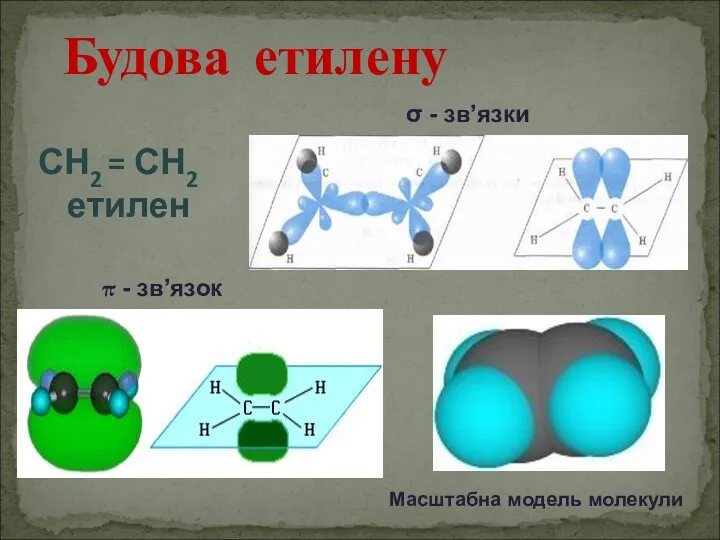
- 4. Будова етилену СН2 = СН2 етилен σ - зв’язки π - зв’язок Масштабна модель молекули
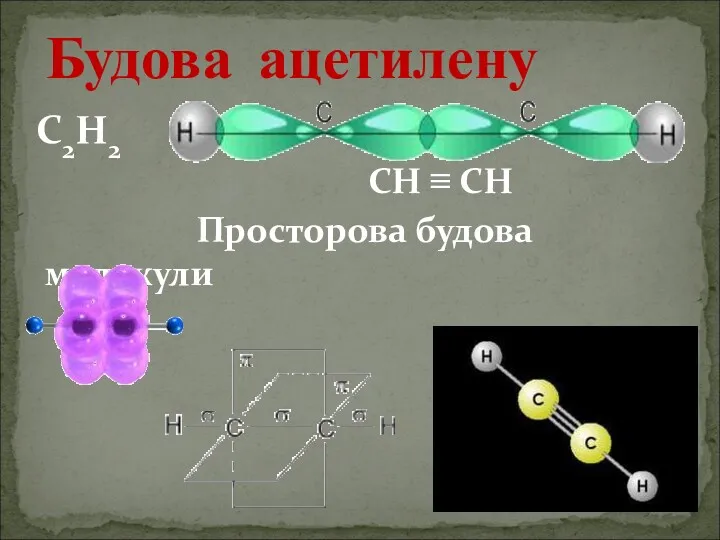
- 5. С2Н2 СН ≡ СН Просторова будова молекули Будова ацетилену
- 6. С2Н4 безбарвний газ; добре розчинний в органічних розчинниках; tплавл = - 169,2 ̊С; вибухонебезпечний Фізичні властивості
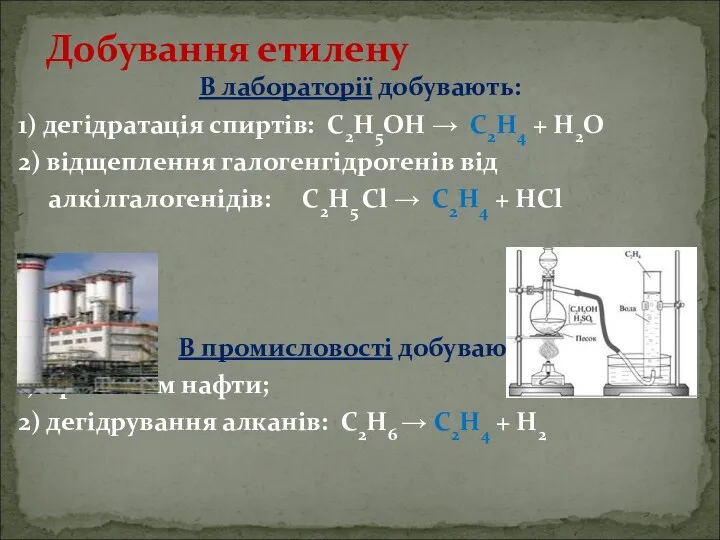
- 7. В лабораторії добувають: 1) дегідратація спиртів: С2Н5ОН → С2Н4 + Н2О 2) відщеплення галогенгідрогенів від алкілгалогенідів:
- 8. С2Н2 безбарвний газ; майже без запаху; малорозчинний у воді, але під тиском добре розчиняється у ацетоні;
- 9. 1836р. - відкритий Е. Деві при розкладанні водою калій карбіду. 1862р. - М. Бертло (франц.) вперше
- 10. Хімічні властивості етилену Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2 +2Н2О 2.
- 11. Горіння (яскравим кіптявим полум’ям): 2С2Н2 + 5O2 → 4СО2 +2Н2О 2. Реакції приєднання по місцю розриву
- 12. Етилен Застосування Ацетилен Висока реакційна здатність зумовлює використання в хімічній промисловості для добування етанолу та етиленгліколю
- 14. Скачать презентацию








 Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2 Спирты и фенолы
Спирты и фенолы Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Купрум. Знаходження в періодичній системі
Купрум. Знаходження в періодичній системі Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Проект: жило-было мыло
Проект: жило-было мыло Сложные эфиры. Жиры
Сложные эфиры. Жиры Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Углекислый газ
Углекислый газ Определение окисляемости воды
Определение окисляемости воды Основные законы и теории. Законы стехиометрии. Теория ионных равновесий. (Лекция 3)
Основные законы и теории. Законы стехиометрии. Теория ионных равновесий. (Лекция 3) Нітроген
Нітроген Электролиз
Электролиз Формы нахождения минералов в природе
Формы нахождения минералов в природе Удивительные свойства воды
Удивительные свойства воды История мыловарения
История мыловарения Основи
Основи Основные синтетические полимеры
Основные синтетические полимеры Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Технология оптического стекла
Технология оптического стекла История открытия химических веществ
История открытия химических веществ Штучні та природні речовини
Штучні та природні речовини Введение в химическую термодинамику
Введение в химическую термодинамику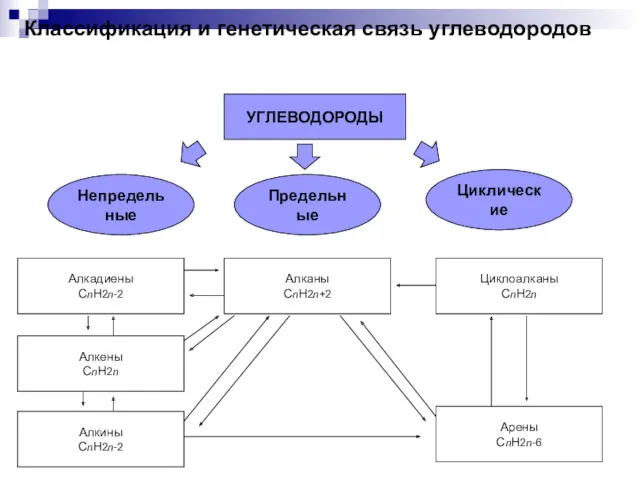 Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов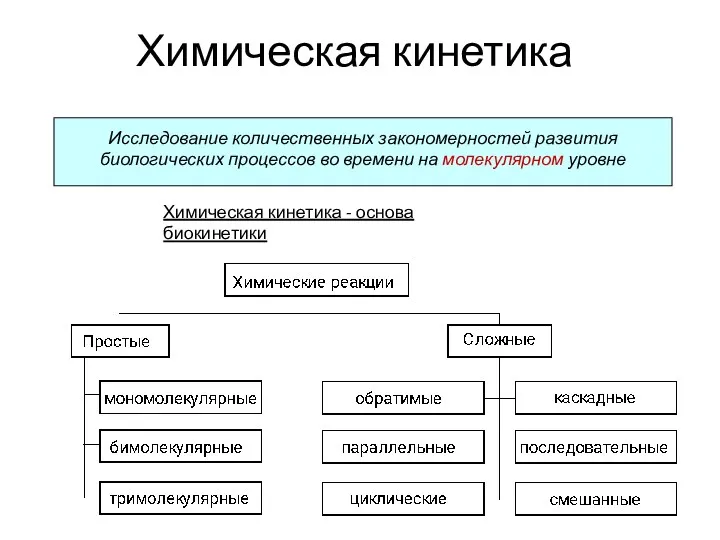 Химическая кинетика
Химическая кинетика Синтетические каучуки: хлоропреновый каучук
Синтетические каучуки: хлоропреновый каучук