Содержание
- 2. Законы стехиометрии Закон сохранения массы (1748 г., М.В.Ломоносов, 1789 г., Лавуазье). Закон постоянства состава (1801 г.,
- 6. Пруст Жозеф Луи (1754-1828 г.)
- 8. Стехиометрия - это совокупность расчетов, основанных на химических формулах и уравнениях реакций. Правило, вытекающее из законов
- 9. Следствие из правила Для расчета концентрации вещества, вступившего или образовавшегося, необходимо и достаточно знать концентрацию какого-либо
- 16. Cильные электролиты Кислоты: HCl, HBr, HI, HNO3, H2SO4 (по 1-ой ступени). Основания: NaOH, KOH, Ca(OH)2, Sr(OH)2,
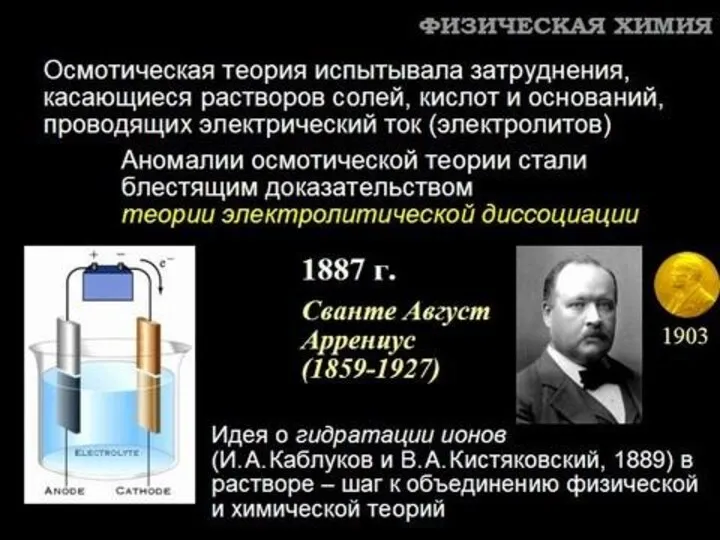
- 17. Теория ионных равновесий Теория электролитической диссоциации С.Аррениуса (1887 г.). Теория сильных электролитов (П.Дебай, Э.Хюккель, 1923 г.).
- 19. Закон начальной концентрации Концентрация любого вещества в растворе равна сумме равновесных концентраций всех ионов, образованных данным
- 20. Закон сохранения заряда Сумма произведений концентрации каждого иона на его заряд равна нулю. Пример: Cr2O72- +
- 21. Теория сильных электролитов (1923 г, Дебай, Хюккель) 1. Сильные электролиты в водных растворах диссоциируют полностью, т.е.
- 22. ДЕБАЙ (Debye), Петер Джозеф Уильям 24 марта 1884 г. – 2 ноября 1966 г. Нобелевская премия
- 23. ХЮККЕЛЬ (Hückel), Эрих Арманд Артур Йозеф 9 августа 1896 г. – 16 февраля 1980 г.
- 24. Теория сильных электролитов K+ + m H2O → [K(OH2)m]+ катионный гидрат A– + n H2O →
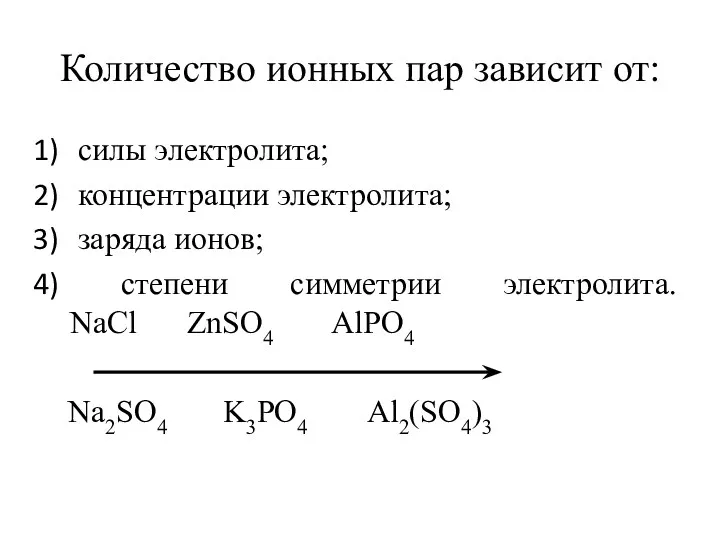
- 25. Количество ионных пар зависит от: силы электролита; концентрации электролита; заряда ионов; степени симметрии электролита. NaCl ZnSO4
- 26. Ионная сила раствора Является мерой электростатического взаимодействия всех ионов в растворе, обозначается I (или μ). I
- 27. Формула Льюиса-Рендалла (1921 г.) Активность (действующая концентрация) ai = Ci ⋅ fi С – истинная концентрация
- 28. Значение I: 0 – 0,05 – 0,1 – 1 2 3 1. I → 0 I=0,05-0,1
- 29. Закон Рендалла (закон ионной силы): при значениях ионной силы ≤ 0,05 коэффициент активности не зависит от
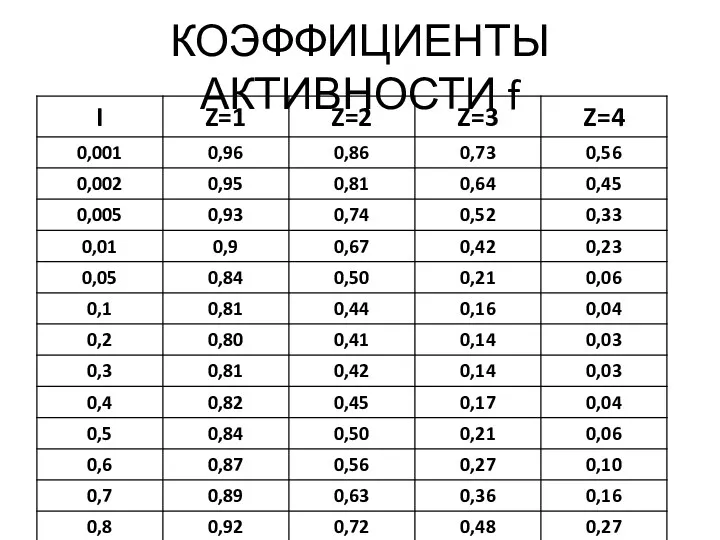
- 30. КОЭФФИЦИЕНТЫ АКТИВНОСТИ f
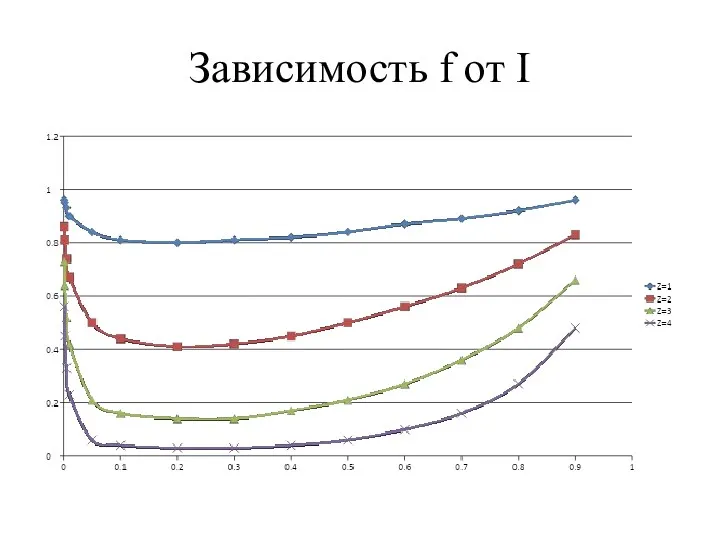
- 31. Зависимость f от I
- 32. Закон действующих масс и его использование в расчетах
- 35. КТ - термодинамическая константа КТ = f (природа вещества, природа растворителя, Т, Р), не зависит от
- 36. Кf - функция активности Кf
- 37. fi известны не только для ионов, но и для молекул сильных электролитов, они называются среднеионными:
- 38. Применение теории сильных электролитов в аналитических расчетах Для раствора, содержащего 0,1 М СаСl2, 0,2 М КСl
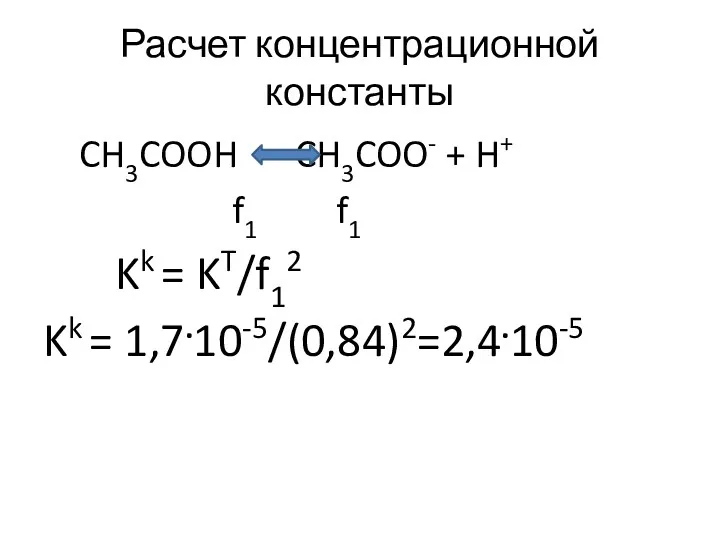
- 39. Расчет концентрационной константы CH3COOH CH3COO- + H+ f1 f1 Kk = KT/f12 Kk = 1,7.10-5/(0,84)2=2,4.10-5
- 41. Скачать презентацию





















![Теория сильных электролитов K+ + m H2O → [K(OH2)m]+ катионный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/410950/slide-23.jpg)


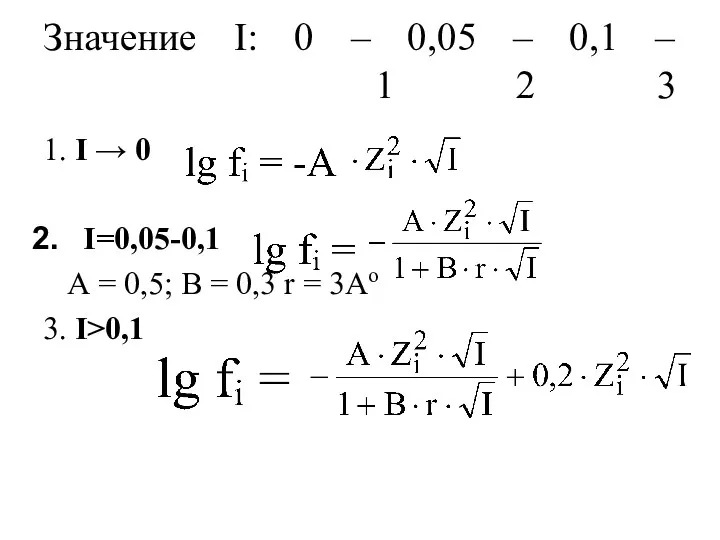








 Хімічні властивості металів
Хімічні властивості металів Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Химические свойства кислот
Химические свойства кислот Кристаллические решетки
Кристаллические решетки Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Хром. Физические и химические свойства
Хром. Физические и химические свойства Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері
Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері Химический факультет
Химический факультет Химия как компонент системы естественнонаучного образования
Химия как компонент системы естественнонаучного образования Cromatografia ionică
Cromatografia ionică Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий и сплавы на его основе
Алюминий и сплавы на его основе Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Как и где используется соляная кислота
Как и где используется соляная кислота Электрохимические процессы
Электрохимические процессы Кислород. Атом кислорода
Кислород. Атом кислорода Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Гранулометрический состав горных пород
Гранулометрический состав горных пород Дезодоранты. Антиперспиранты
Дезодоранты. Антиперспиранты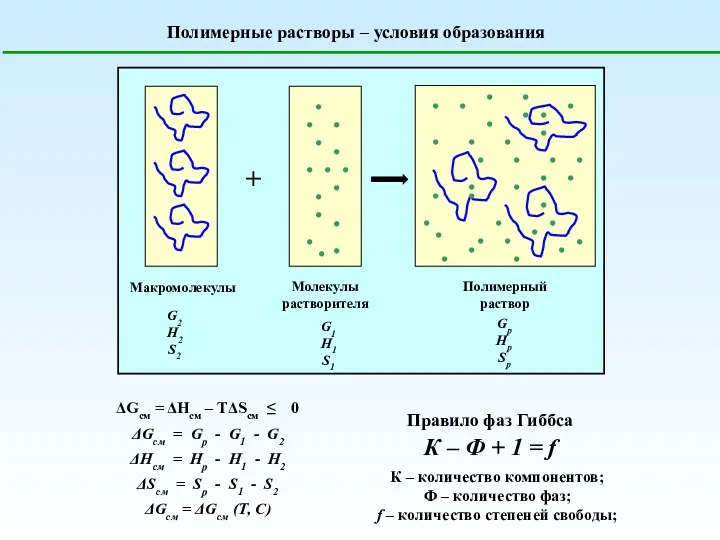 Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Химиялық тепе-теңдік
Химиялық тепе-теңдік Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов