Содержание
- 2. Цели урока: обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе; аллотропных
- 3. Прав ли был Артур Конан-Дойл?
- 4. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 5. период Фосфор как химический элемент группа валентных электронов степени окисления высший оксид водородное соединение
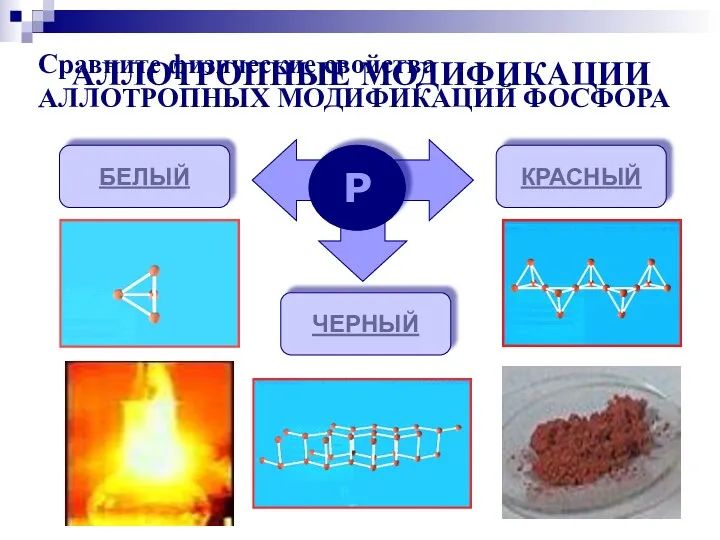
- 6. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 7. С металлами: Ca + P = C неметаллами: P + O2 = P + S =
- 8. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
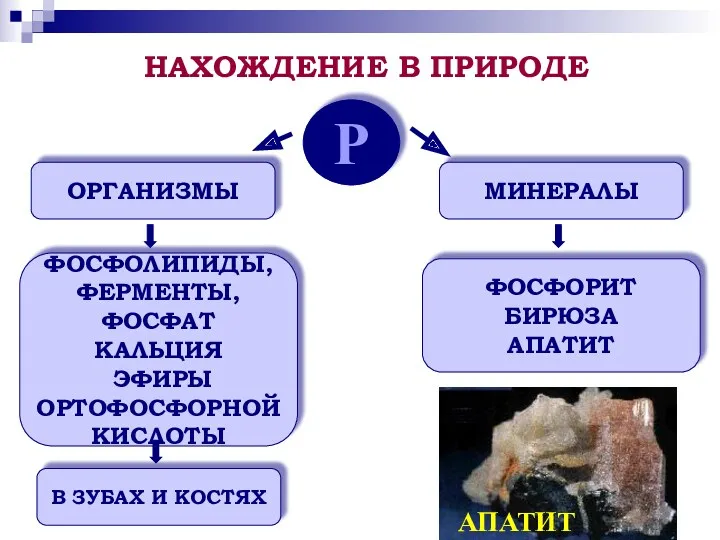
- 9. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 10. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
- 11. Получение фосфора нагреванием смеси фосфорита, угля и песка в электропечи: Ca3(PO4)2 + C + SiO2 →
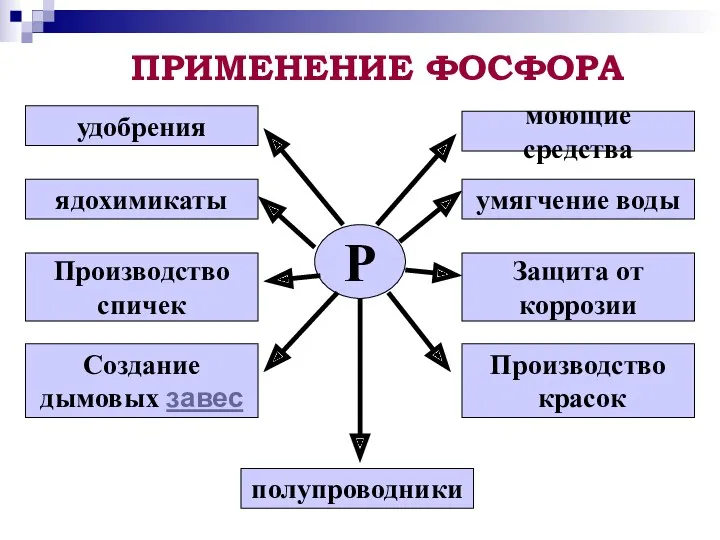
- 12. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 13. ДОМАШНЕЕ ЗАДАНИЕ Индивидуальные задания. Подготовить сообщения: 1)об истории спичек; 2) о биологической роли фосфора и его
- 14. СПАСИБО ЗА УРОК!
- 15. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 16. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
- 17. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
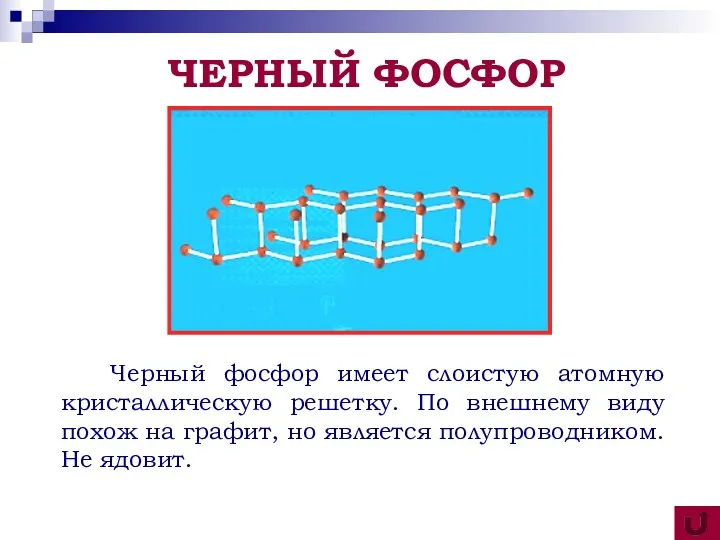
- 18. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 19. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
- 21. Скачать презентацию














 Углеводы. Моносахариды
Углеводы. Моносахариды Реакции ионного обмена
Реакции ионного обмена Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Донорно-акцепторний механізм утворення ковалентного зв’язку
Донорно-акцепторний механізм утворення ковалентного зв’язку История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений
История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений Кислород и озон
Кислород и озон Углеводороды из Башкортостана
Углеводороды из Башкортостана Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Производные фенантренизохинолина
Производные фенантренизохинолина Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Ионная химическая связь
Ионная химическая связь Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений
Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118
Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118 Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Реакции ионного обмена
Реакции ионного обмена Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Термические процессы нефтепереработки
Термические процессы нефтепереработки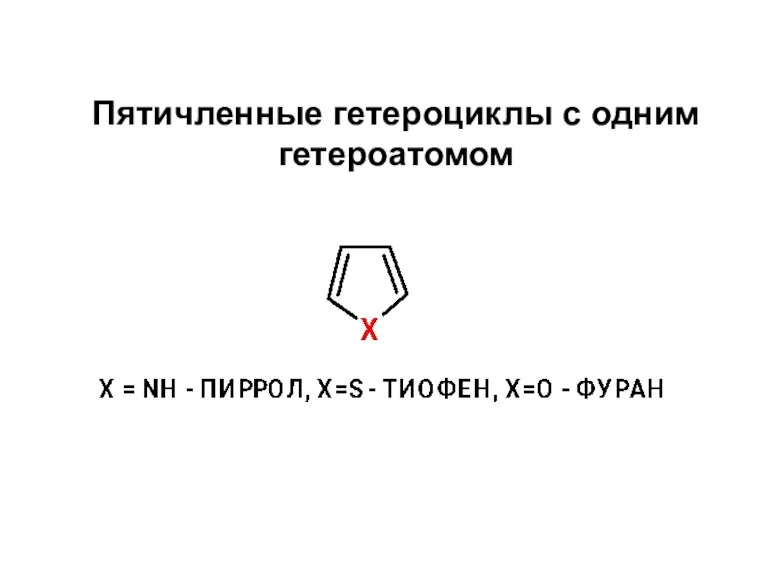 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Медь, цинк, хром. Обобщающий урок
Медь, цинк, хром. Обобщающий урок Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Основания (3)
Основания (3)