Содержание
- 2. Степень окисления. Определение степени окисления в соединениях
- 3. В соединениях с ионной связью степени окисления элементов равна зарядам ионов
- 4. В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равна 0 Н2°,
- 5. Степень окисления элемента – это условный заряд его атома, в молекуле, если считать, что молекула состоит
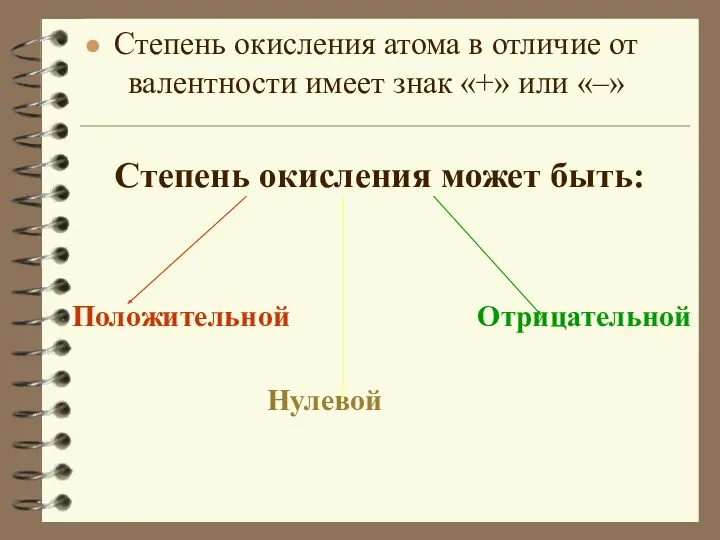
- 6. Степень окисления атома в отличие от валентности имеет знак «+» или «–» Степень окисления может быть:
- 7. Валентность обозначатся римскими цифрами сверху символа элемента: II I IV Fe Cu S а степень окисления
- 8. Положительная степень окисления –равна числу электронов, отданных данным атомам. Атом может отдать все валентные электроны (
- 9. Отрицательная степень окисления равна числу электронов, принятых данным атомом, ее проявляют только неметаллы. Атомы неметаллов присоединяют
- 10. У элементов главных подгрупп IV-VII групп минимальная степень окисления численно равна Номер группы - 8 =
- 11. Значение степени окисления между высшим и низшим степенями окислений называется промежуточным. Например: S+6 высшая низшая S-2
- 12. Для определения степени окисления атома в соединении следует учитывать ряд положений: Степень окисления F во всех
- 13. Алгоритм составления формулы в соединениях: 1 способ На первом месте пишется элемент с меньшей электроотрицательностью, на
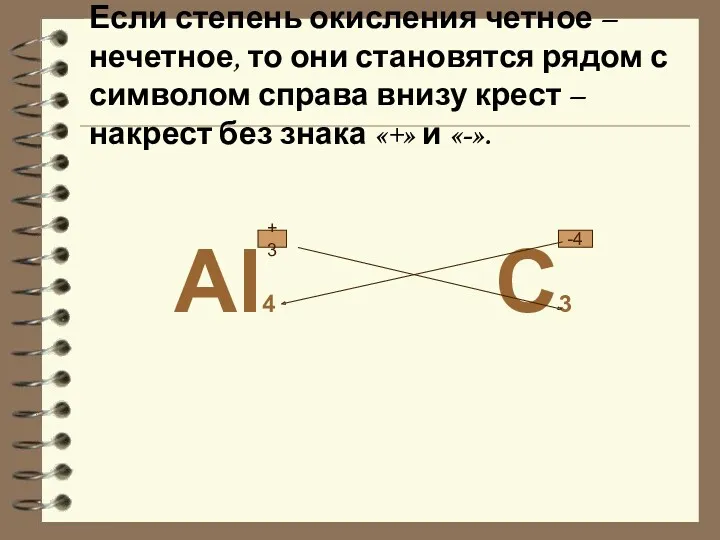
- 14. Если степень окисления четное – нечетное, то они становятся рядом с символом справа внизу крест –
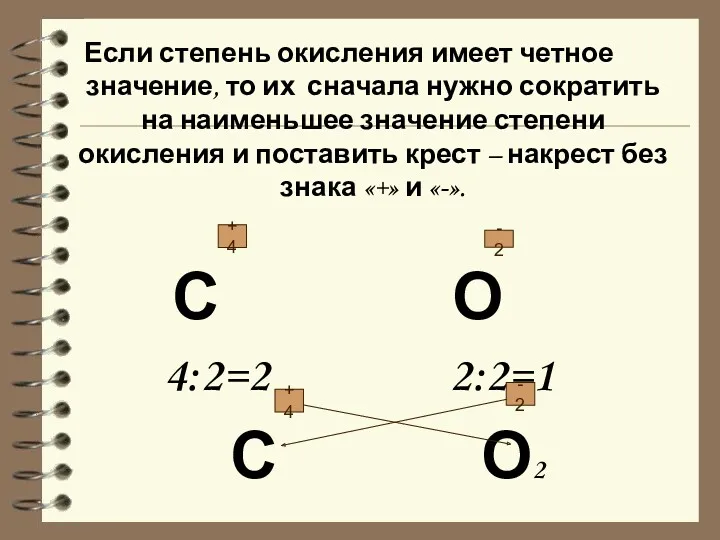
- 15. Если степень окисления имеет четное значение, то их сначала нужно сократить на наименьшее значение степени окисления
- 16. 2 способ 1) Обозначим степень окисления N через Х, указать степень окисления О N2 О3 2)
- 17. 4) Составить алгебраическое уравнение: 2Х+ (-6)=0 2Х =6 Х=6:2 Х=3 N2 О3 +3 -2
- 18. Электроотрицательность - это свойство атомов элемента оттягивать на себя электроны от атомов других элементов в соединениях
- 19. Л. Полинг
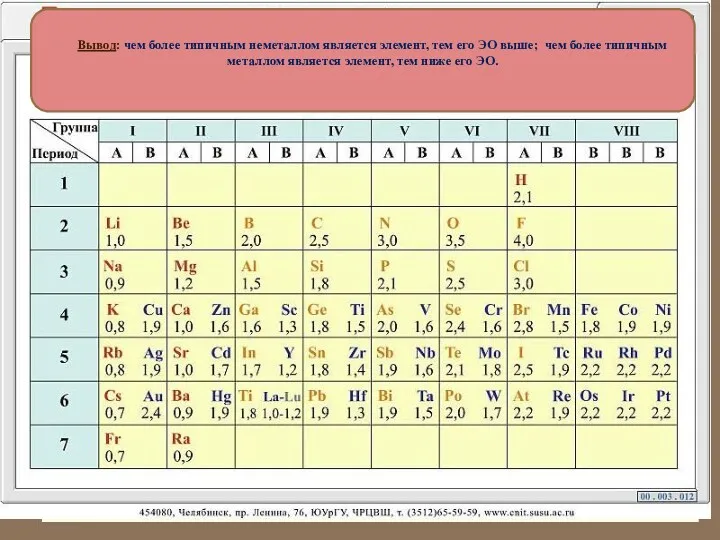
- 20. Вывод: чем более типичным неметаллом является элемент, тем его ЭО выше; чем более типичным металлом является
- 22. Подумайте, к какому элементу сместятся электроны при образовании соединения: NH3; HCl; P2O5; CH4.
- 24. Скачать презентацию

















 Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Минералы и горные породы
Минералы и горные породы Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Способы получения металлов
Способы получения металлов Вуглеводи
Вуглеводи Соли. 8 класс
Соли. 8 класс General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Все о чае
Все о чае Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Вещества
Вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Электролиз. Электролизеры
Электролиз. Электролизеры Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Первичная структура белков и пептидов
Первичная структура белков и пептидов Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Углерод
Углерод Химический элемент и формы его существования
Химический элемент и формы его существования Век пластмасс
Век пластмасс Синтетический каучук и его применение
Синтетический каучук и его применение 20231009_zhyostkost_vody
20231009_zhyostkost_vody Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Платина. Физические и химические свойства
Платина. Физические и химические свойства Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Алюминий и его соединения
Алюминий и его соединения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Каучук. Открытие каучука
Каучук. Открытие каучука