Слайд 2
Электролиз - окислительно-восстановительные процессы, протекающие на электродах при пропускании постоянного электрического тока через
раствор или расплав электролита.
Слайд 3Процесс перехода электрической энергии в химическую осуществляется в электролизере.
При электролизе катод заряжен отрицательно,
а анод – положительно. Катод соединяется с отрицательным полюсом источника электрического тока, а анод подключается к его положительному полюсу.
Слайд 5Электролиз расплавов
Пример электролиза расплава хлорида меди (II):
CuCl2 = Cu +CL2 ↑
CuCl2
→ Cu2+ + 2Cl-
K- A+
Cu2+ +2e = Cu0 Cl- - e = Cl0
2Cl- = Cl2 ↑
Слайд 61.Соль активного металла и бескислородной кислоты
KCl ↔ K+ + Cl−
K"катод"(-): K+ + 1e
= K0
A"анод"(+): 2Cl− — 1e = Cl20;
Вывод: 2КCl → (электролиз) 2K + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
CsOH ↔ Cs+ + OH−
K(-): Cs+ +1e =Cs0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4CsOH→ 4Cs + 2H2O + O2
Слайд 7
Электролиз растворов
Катодные процессы определяются окислительной активностью катионов
Рассмотрим таблицу:
Слайд 9 Электролиз раствора иодида калия
Анодные процессы зависят не только от характера аниона, но
и от материала анода.
Если анод растворим, то при электролизе происходит окисление металла анода:
Me0 - ne = Men+
анод переходит в раствор
Слайд 10В случае нерастворимого анода возможны следующие процессы:
Слайд 14Применение электролиза:
При электролизе расплавов солей и щелочей в промышленности получают активные металлы (
щелочные, щелочноземельные, бериллий, магний, алюминий).
Электролиз растворов лежит в основе гальванотехники:
 Розв’язання експериментальних задач. Практична робота №2
Розв’язання експериментальних задач. Практична робота №2 Алюминий и его соединения
Алюминий и его соединения Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах
Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Хімічні властивості алканів
Хімічні властивості алканів Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Окислительно-восстановительные реакции в аналитической химии
Окислительно-восстановительные реакции в аналитической химии Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Органіка. Органічні речовини
Органіка. Органічні речовини Хімічні явища у природі
Хімічні явища у природі Вода. Анализ и синтез. Состав оснований
Вода. Анализ и синтез. Состав оснований Липиды. Классификация
Липиды. Классификация Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Предельные углеводороды. Алканы. 10 класс
Предельные углеводороды. Алканы. 10 класс Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Алюминий и его соединения
Алюминий и его соединения Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Кислород. Атом кислорода
Кислород. Атом кислорода Медь и ее сплавы
Медь и ее сплавы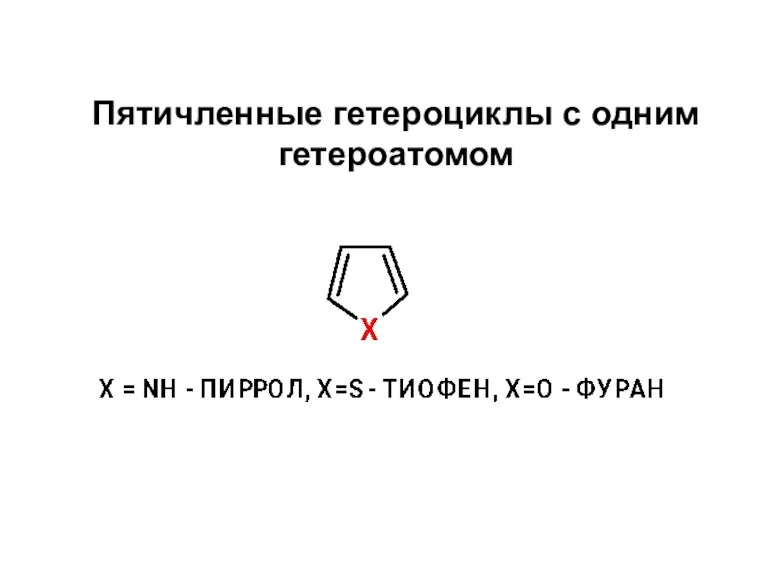 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Почему нефть называют черным золотом
Почему нефть называют черным золотом Хром
Хром Классификация химических элементов. Периодический закон Д.И. Менделеева
Классификация химических элементов. Периодический закон Д.И. Менделеева Основные классы неорганических соединений
Основные классы неорганических соединений Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба?