Содержание
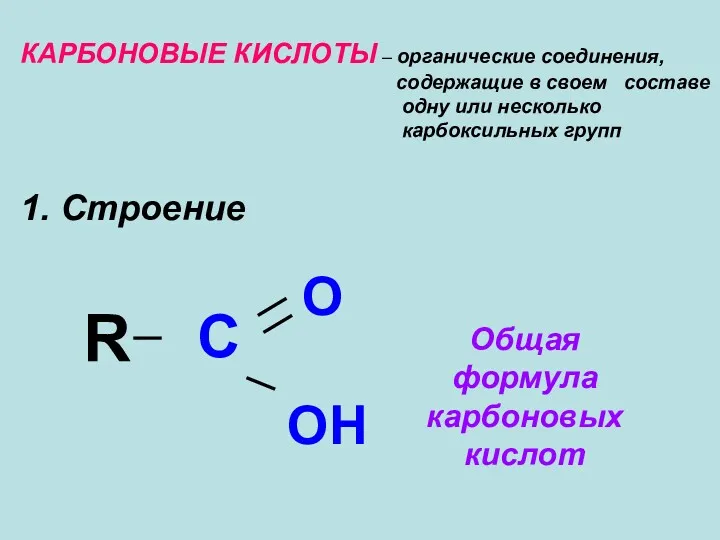
- 2. КАРБОНОВЫЕ КИСЛОТЫ – органические соединения, содержащие в своем составе одну или несколько карбоксильных групп 1. Строение
- 3. СnH2nO2 Общая формула карбоновых кислот Атом углерода карбоксильной группы находится в состоянии sp2 – гибридизации, он
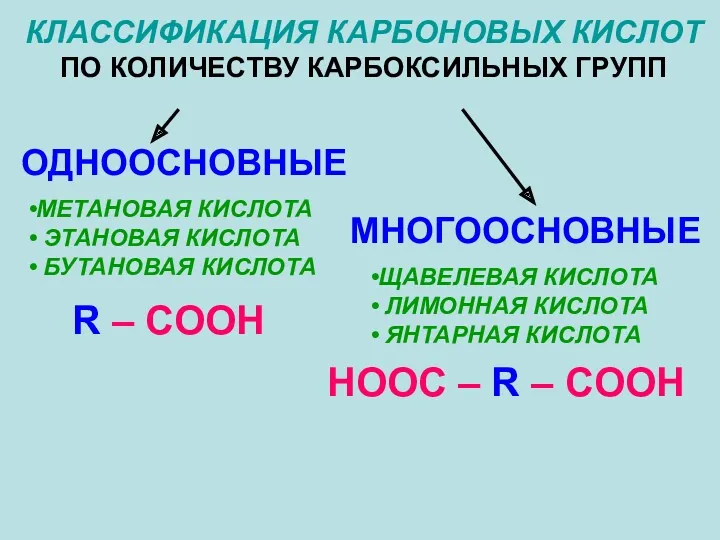
- 4. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ ПО КОЛИЧЕСТВУ КАРБОКСИЛЬНЫХ ГРУПП ОДНООСНОВНЫЕ МНОГООСНОВНЫЕ МЕТАНОВАЯ КИСЛОТА ЭТАНОВАЯ КИСЛОТА БУТАНОВАЯ КИСЛОТА ЩАВЕЛЕВАЯ
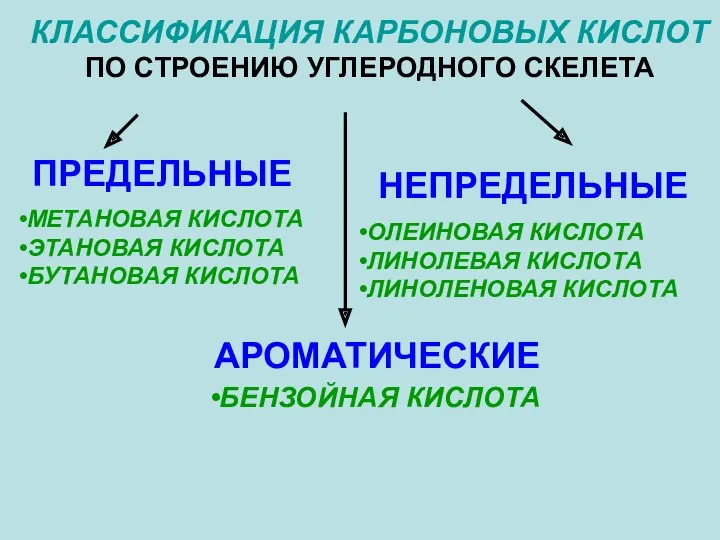
- 5. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ ПО СТРОЕНИЮ УГЛЕРОДНОГО СКЕЛЕТА ПРЕДЕЛЬНЫЕ НЕПРЕДЕЛЬНЫЕ АРОМАТИЧЕСКИЕ МЕТАНОВАЯ КИСЛОТА ЭТАНОВАЯ КИСЛОТА БУТАНОВАЯ КИСЛОТА
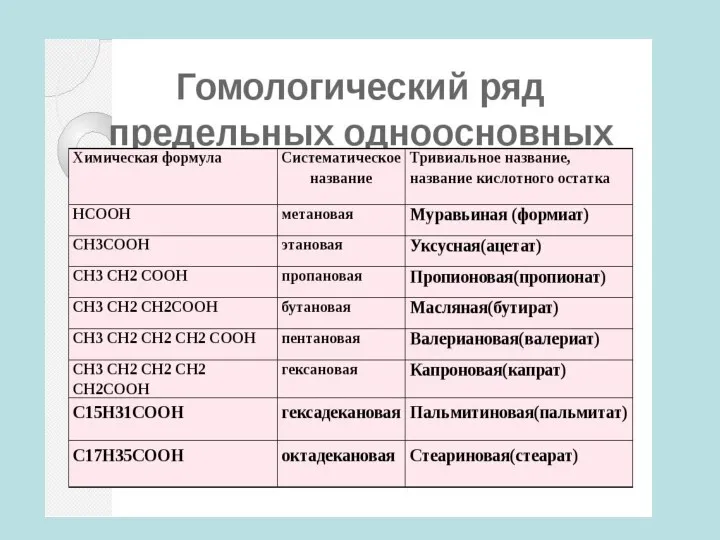
- 6. 2. НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ Алгоритм составления названий: 1. Найдите главную (самую длинную) цепь углеводородных атомов (включая
- 7. МЕТАНОВАЯ КИСЛОТА (МУРАВЬИНАЯ КИСЛОТА)
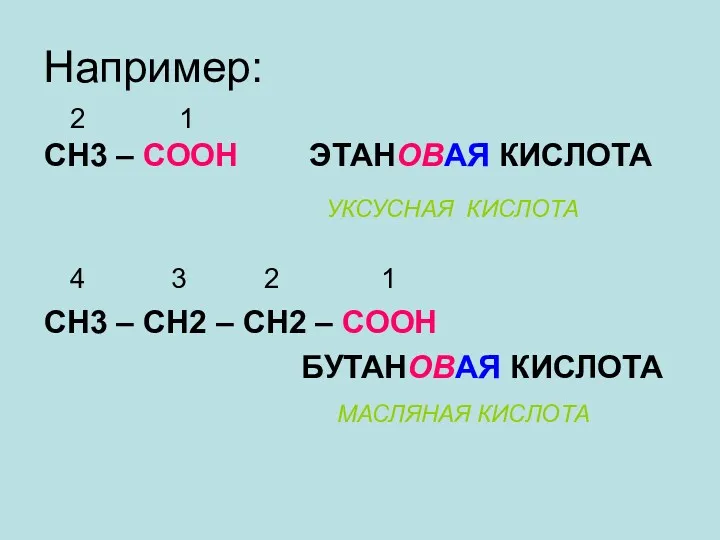
- 8. Например: 2 1 СН3 – СООН ЭТАНОВАЯ КИСЛОТА 4 3 2 1 СН3 – СН2 –
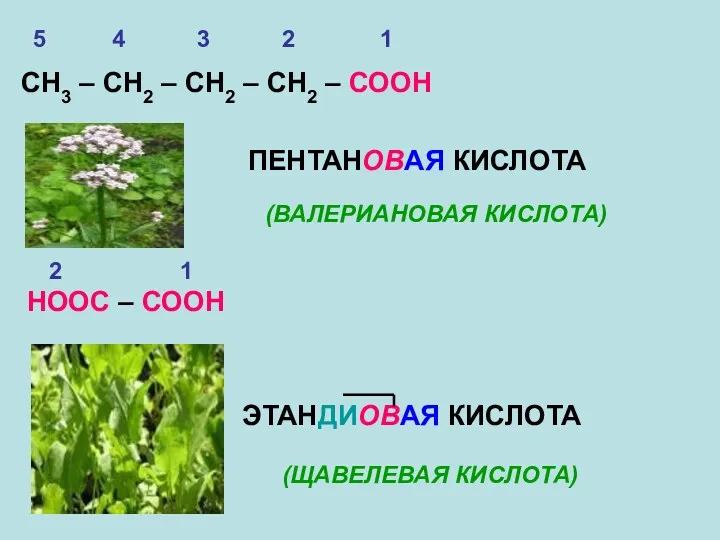
- 9. СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАНОВАЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) НООС – СООН
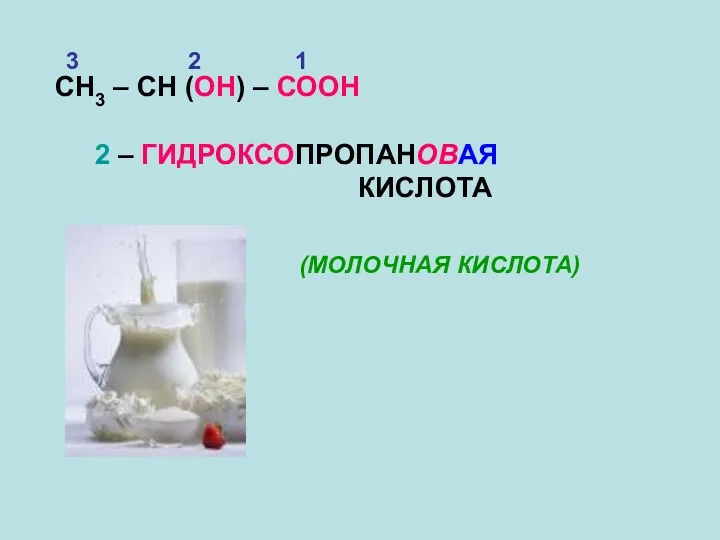
- 10. СН3 – СН (ОН) – СООН 1 2 3 2 – ГИДРОКСОПРОПАНОВАЯ КИСЛОТА (МОЛОЧНАЯ КИСЛОТА)
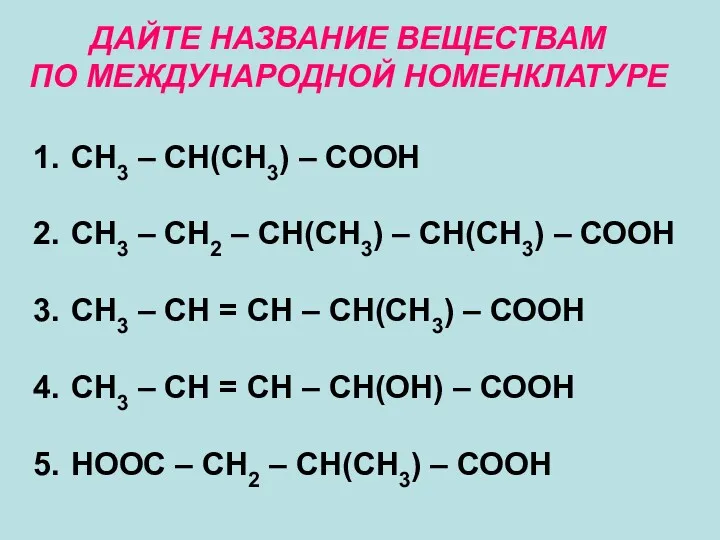
- 12. ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ СН3 – СН(СН3) – СООН СН3 – СН2 – СН(СН3)
- 13. ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ Для предельных карбоновых кислот: УГЛЕРОДНОГО СКЕЛЕТА МЕЖКЛАССОВАЯ (СЛОЖНЫЕ ЭФИРЫ) Для непредельных карбоновых кислот:
- 14. 3. Свойства 3.1.Физические С1 – С3 С4 – С9 C10 и > Жидкости с характерным резким
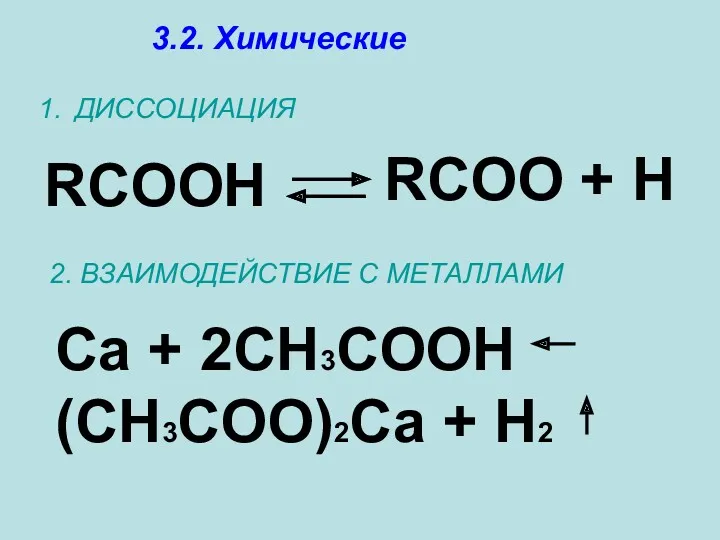
- 15. 3.2. Химические ДИССОЦИАЦИЯ RCOOH RCOO + H 2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ Ca + 2CH3COOH (CH3COO)2Ca +
- 16. 3.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ 2 R – COOH + MgO = (R – COO)2Mg + H2O
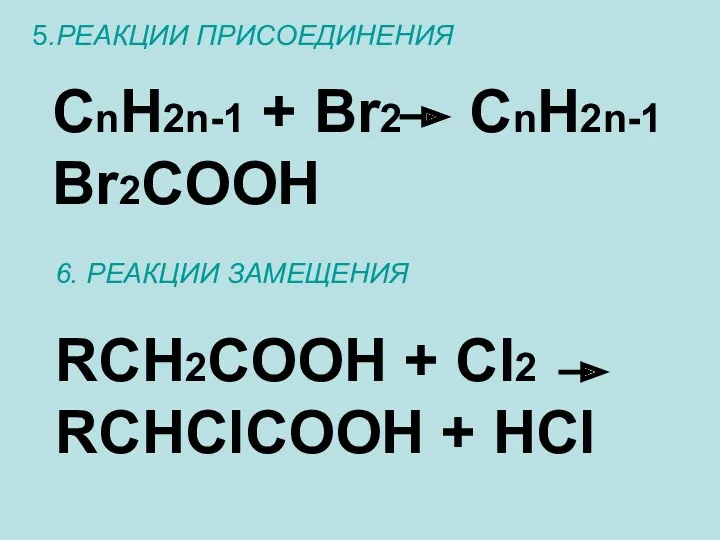
- 17. 5.РЕАКЦИИ ПРИСОЕДИНЕНИЯ CnH2n-1 + Br2 CnH2n-1 Br2COOH 6. РЕАКЦИИ ЗАМЕЩЕНИЯ RCH2COOH + Cl2 RCHClCOOH + HCl
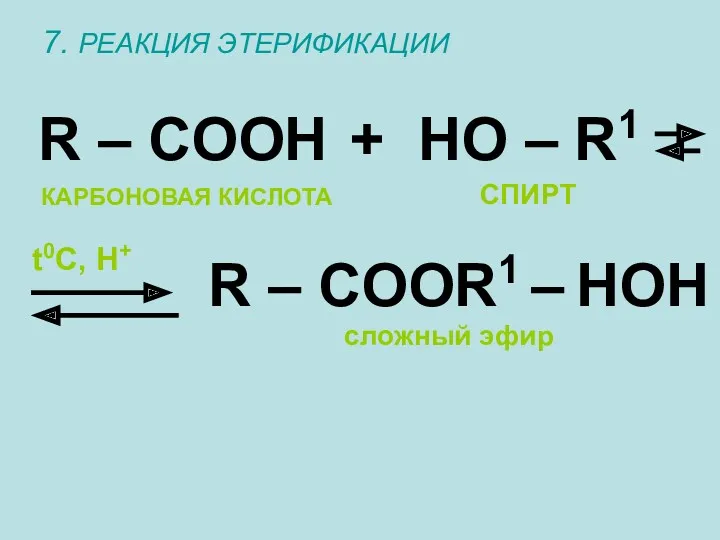
- 18. 7. РЕАКЦИЯ ЭТЕРИФИКАЦИИ R – COOH + HO – R1 R – COOR1 – HOH t0C,
- 20. Скачать презентацию





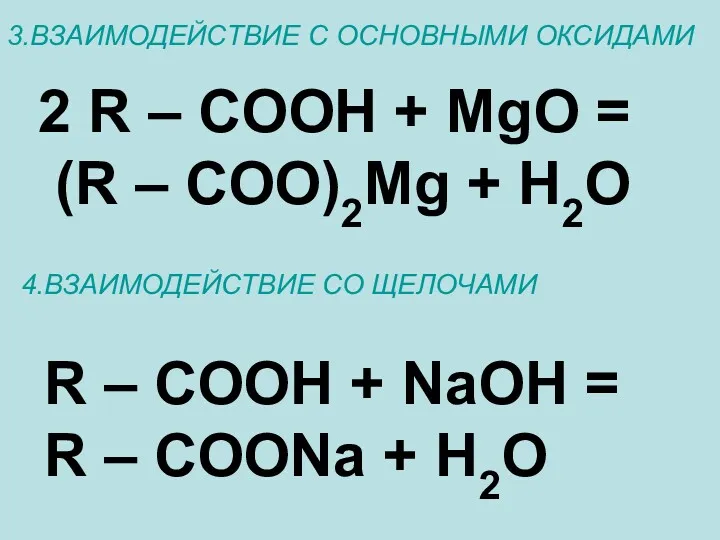
 Кластер Химические реакции
Кластер Химические реакции Петрография
Петрография Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Характеристика металу Ферум
Характеристика металу Ферум Художественная обработка камня
Художественная обработка камня Природный газ
Природный газ Алкени i Алкіни. Загальна та молекулярні формули, структурна ізомерія, систематична номенклатура
Алкени i Алкіни. Загальна та молекулярні формули, структурна ізомерія, систематична номенклатура Тұндыру әдістері
Тұндыру әдістері Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Коррозия металлов
Коррозия металлов Химический состав клетки. Вода
Химический состав клетки. Вода Алюминий IIIА топ элементі
Алюминий IIIА топ элементі 20231002_ammiak
20231002_ammiak Етери та естери
Етери та естери Карбонаты и гидрокарбонаты. Тест – экспресс
Карбонаты и гидрокарбонаты. Тест – экспресс Алкины. Гомологический ряд
Алкины. Гомологический ряд Понятие биогенности химических элементов
Понятие биогенности химических элементов Вивчення властивостей полімерів і синтетичних волокон. Лабораторна робота
Вивчення властивостей полімерів і синтетичних волокон. Лабораторна робота Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Физические и химические явления
Физические и химические явления Хроматографические методы анализа
Хроматографические методы анализа ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Химический элемент. Неон
Химический элемент. Неон Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода