Содержание
- 2. Органическая химия – химия соединений углерода Кроме углерода и водорода в составе молекул могут быть: кислород,
- 3. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А.М. БУТЛЕРОВ (1881) ОСНОВНЫЕ ПОЛОЖЕНИЯ 1. Углерод в органических соединениях всегда четырехвалентен.
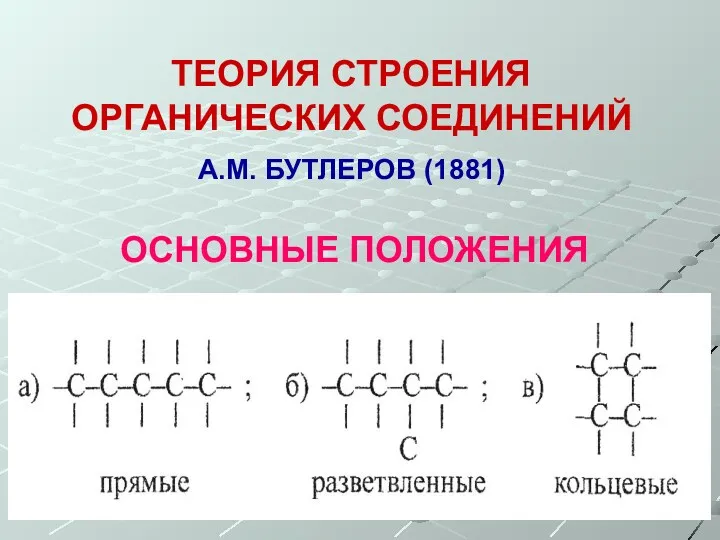
- 4. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А.М. БУТЛЕРОВ (1881) ОСНОВНЫЕ ПОЛОЖЕНИЯ 2. Атомы углерода соединяются между собой, образуя
- 5. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А.М. БУТЛЕРОВ (1881) ОСНОВНЫЕ ПОЛОЖЕНИЯ 3. Свойства веществ зависят не только от
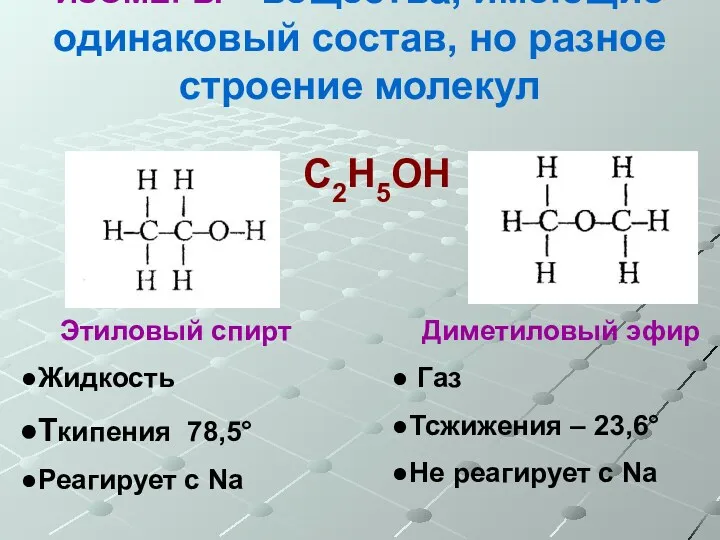
- 6. ИЗОМЕРЫ – вещества, имеющие одинаковый состав, но разное строение молекул С2Н5ОН Этиловый спирт Жидкость Ткипения 78,5°
- 7. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А.М. БУТЛЕРОВ (1881) ОСНОВНЫЕ ПОЛОЖЕНИЯ 4. Атомы в молекуле взаимно влияют друг
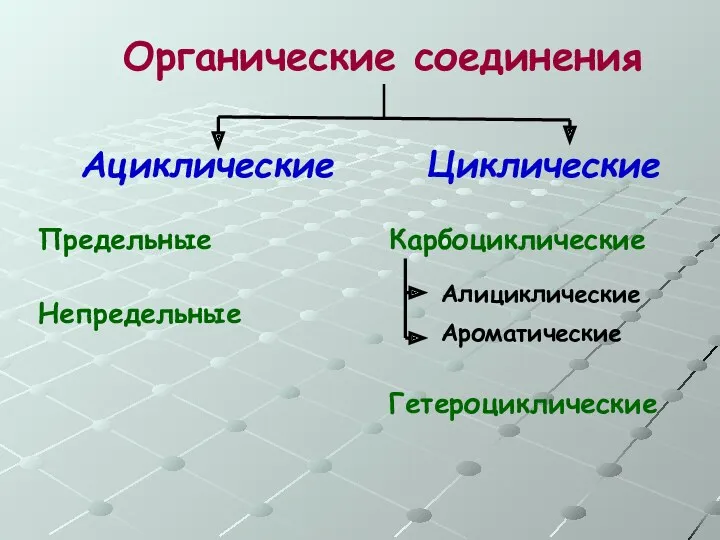
- 8. Органические соединения Ациклические Циклические Предельные Непредельные Ароматические Алициклические Карбоциклические Гетероциклические
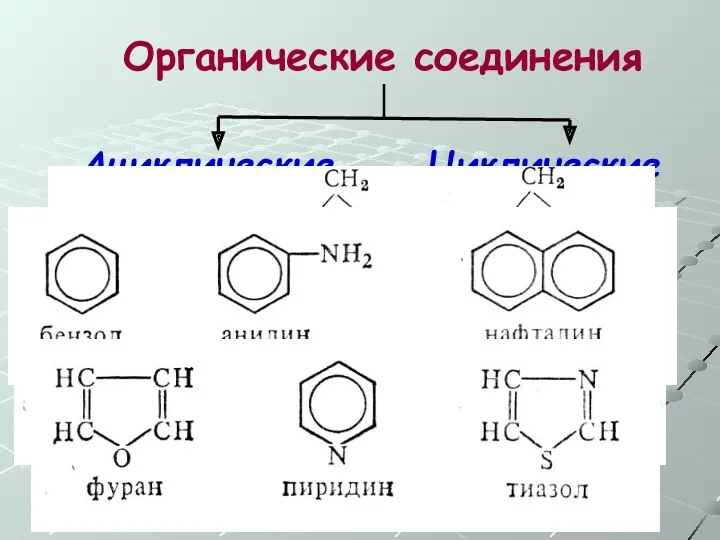
- 9. Органические соединения Ациклические Циклические Предельные Непредельные Ароматические Алициклические Карбоциклические Гетероциклические
- 10. Предельные углеводороды (алканы, насыщенные углеводороды, парафины) Общая формула СnH2n+2
- 11. Предельные углеводороды Физические свойства: До 4 С – газы, от 5 до 7 С – жидкости,
- 12. Предельные углеводороды Химические свойства: 1. Реакции замещения А) галогенирование Б) нитрование
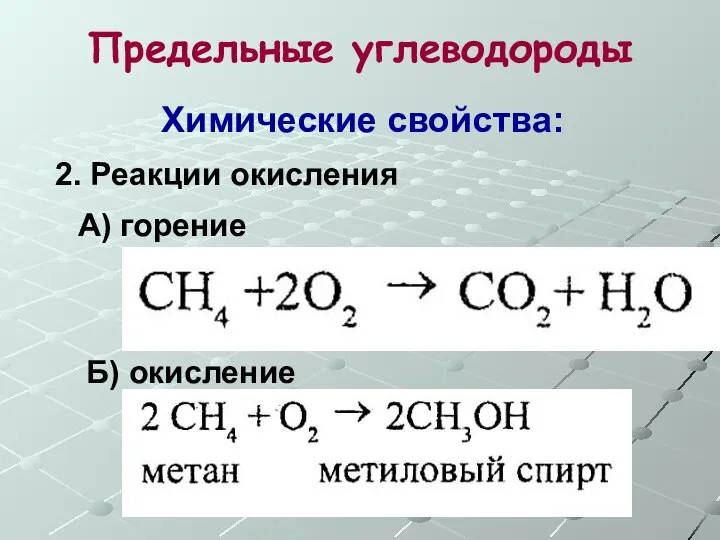
- 13. Предельные углеводороды Химические свойства: 2. Реакции окисления А) горение Б) окисление
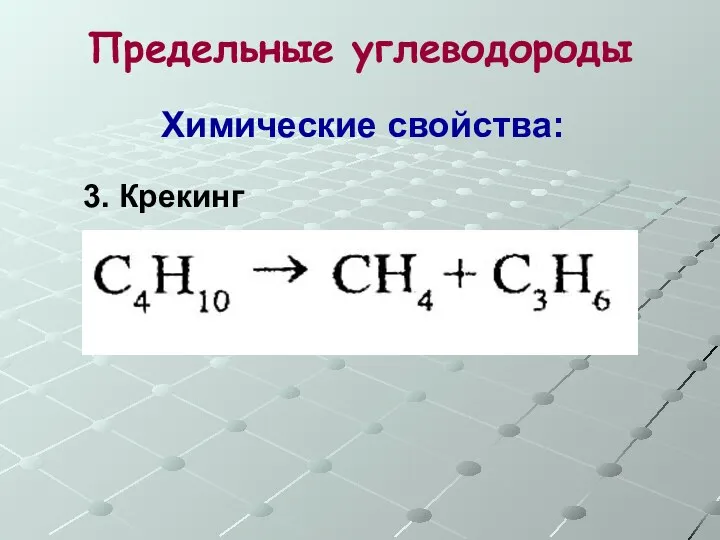
- 14. Предельные углеводороды Химические свойства: 3. Крекинг
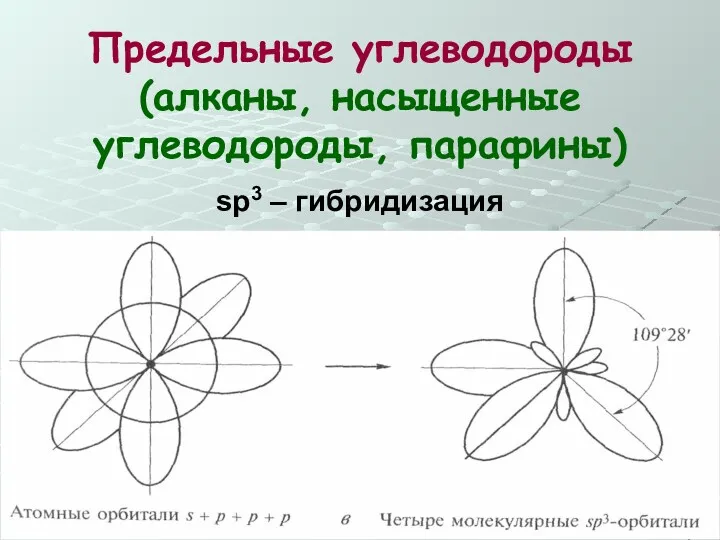
- 15. Предельные углеводороды (алканы, насыщенные углеводороды, парафины) sp3 – гибридизация
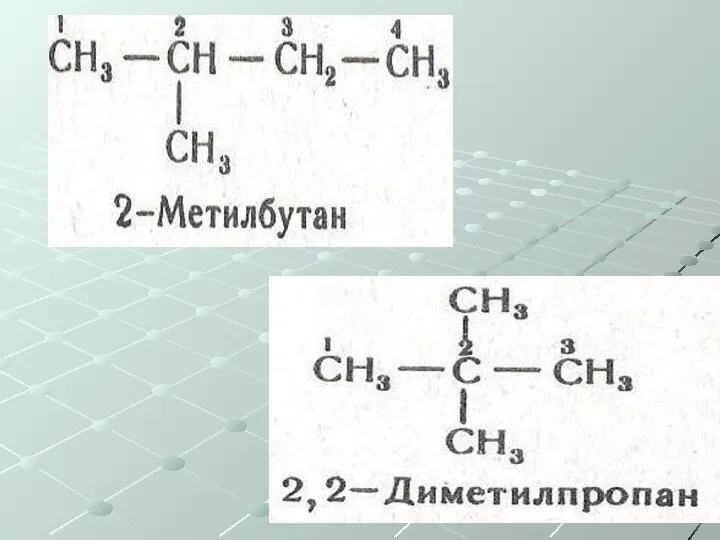
- 16. Предельные углеводороды Характерна изомерия углеродного скелета
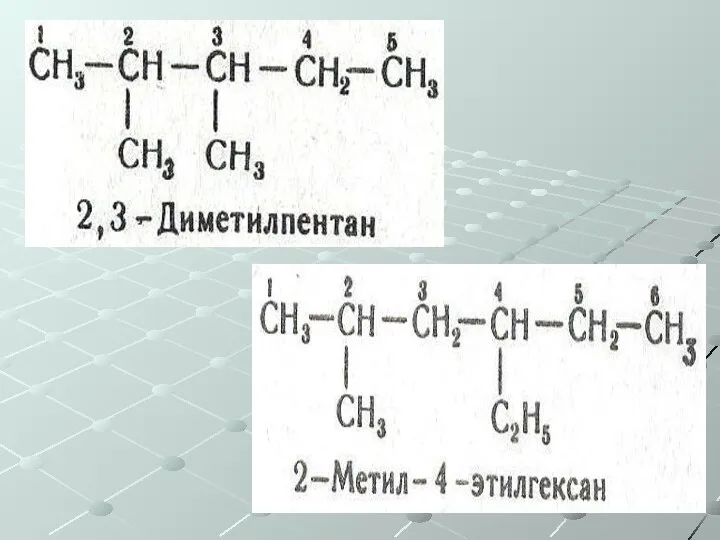
- 17. Номенклатура 1. Выбирается самая длинная цепь. 2. Нумеруются атомы в главной цепи, начиная с конца, к
- 20. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n Физические свойства: До 4 С – газы, от 5 до
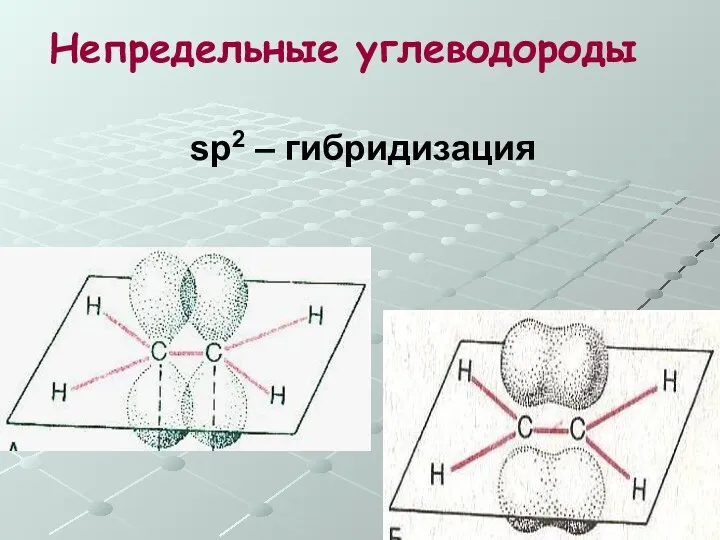
- 21. Непредельные углеводороды sp2 – гибридизация
- 22. Непредельные углеводороды Химические свойства: 1. Реакции присоединения А) гидрирование Б) галогенирование
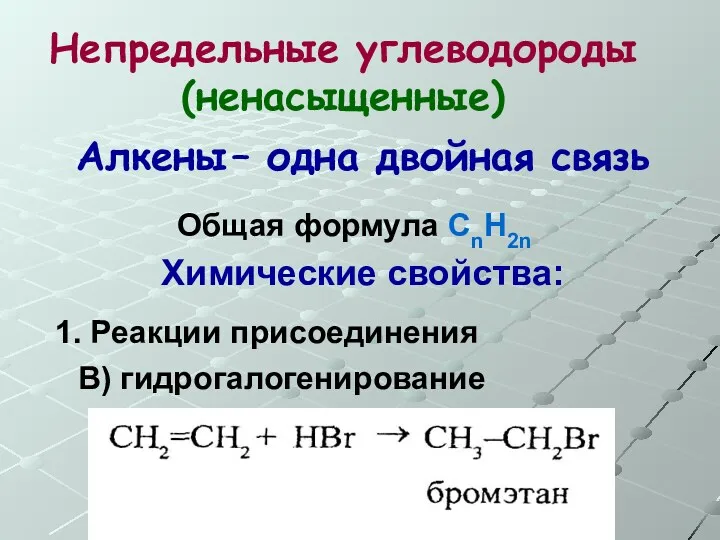
- 23. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n Алкены – одна двойная связь Химические свойства: 1. Реакции присоединения
- 24. ПРАВИЛО МАРКОВНИКОВА Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи (связанному с наибольшим
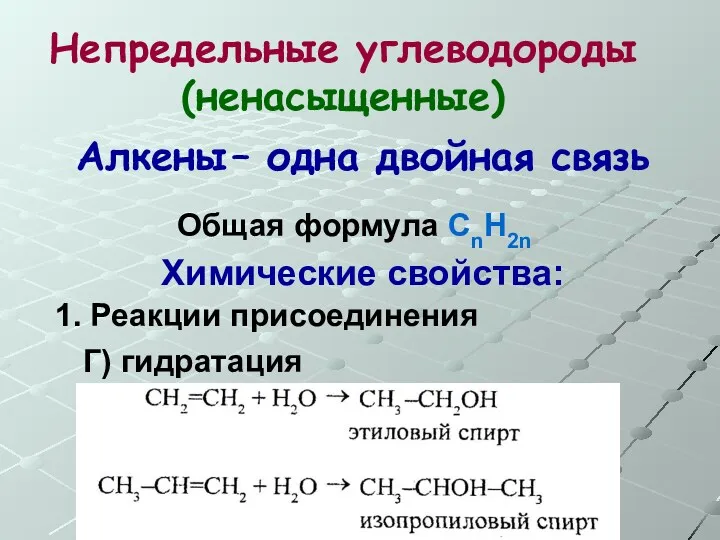
- 25. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n Алкены – одна двойная связь Химические свойства: 1. Реакции присоединения
- 26. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n Алкены – одна двойная связь Химические свойства: 2. Реакции полимеризации
- 27. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n Алкены – одна двойная связь Химические свойства: 3. Реакции окисления
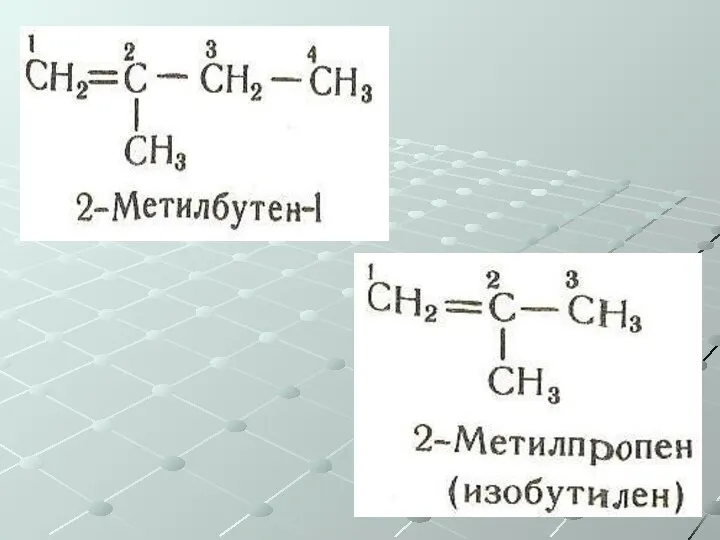
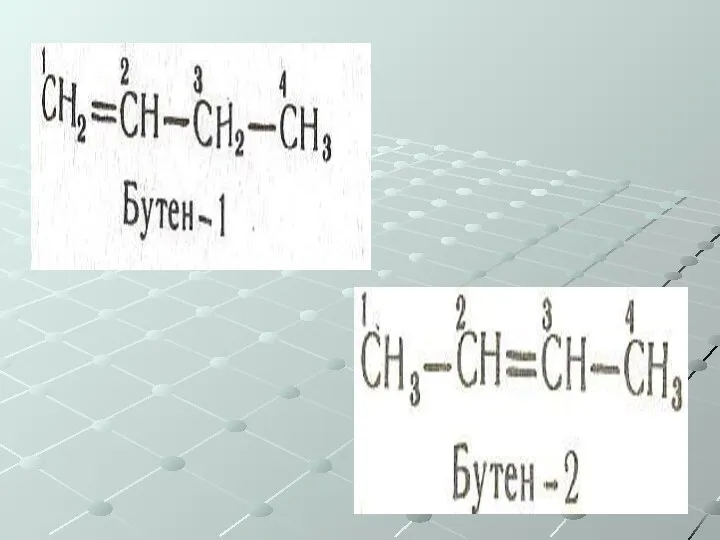
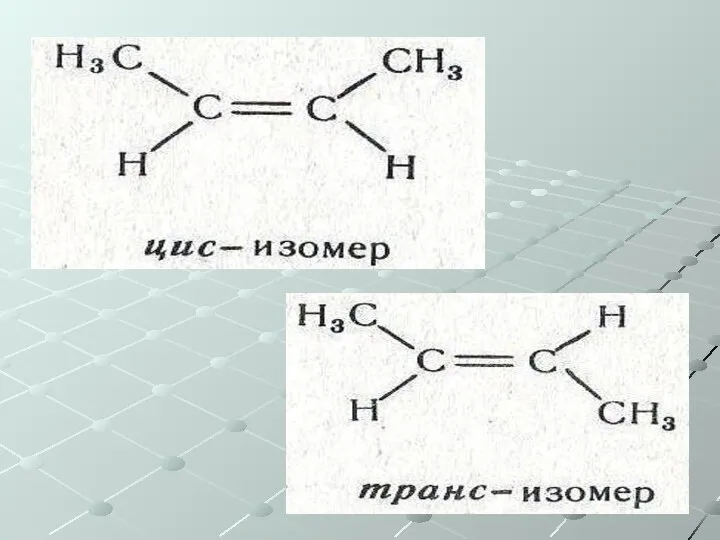
- 28. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n Алкены – одна двойная связь Изомерия: Углеродного скелета Положения двойной
- 32. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкадиены – две двойных связи
- 33. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкадиены – две двойных связи Изомерия: Углеродного скелета Положения двойных
- 35. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь
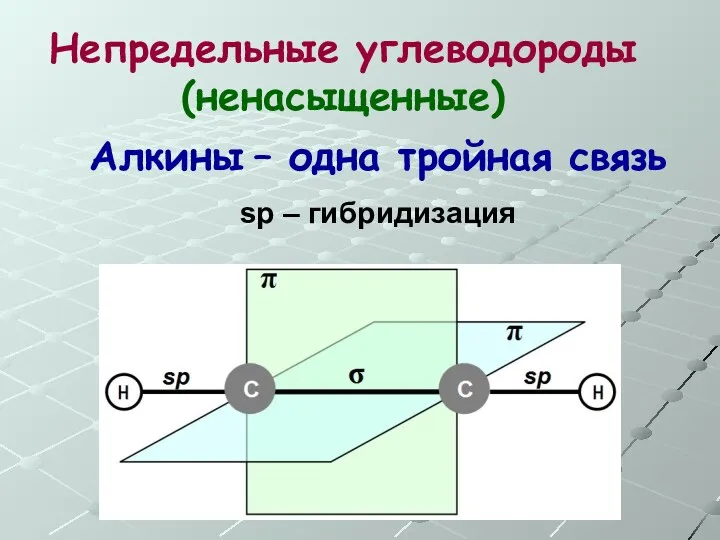
- 36. Непредельные углеводороды (ненасыщенные) Алкины – одна тройная связь sp – гибридизация
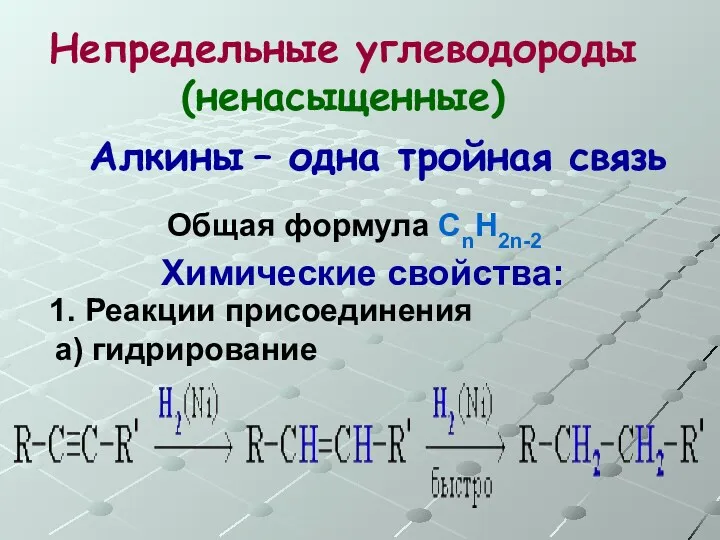
- 37. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Химические свойства: 1. Реакции присоединения
- 38. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Химические свойства: 1. Реакции присоединения
- 39. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Химические свойства: 1. Реакции присоединения
- 40. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Химические свойства: 1. Реакции присоединения
- 41. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Химические свойства: 2. Реакция замещения
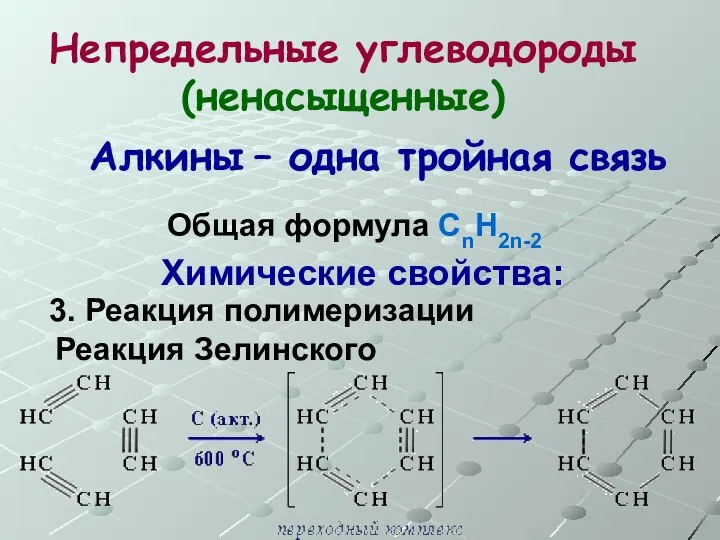
- 42. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Химические свойства: 3. Реакция полимеризации
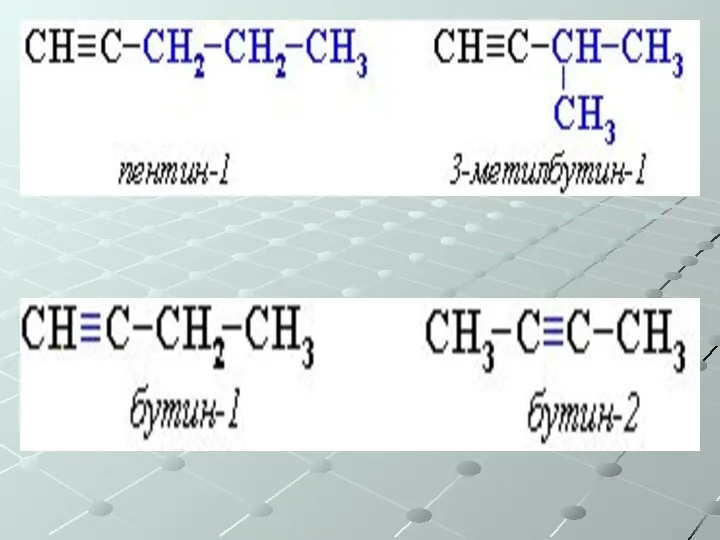
- 43. Непредельные углеводороды (ненасыщенные) Общая формула СnH2n-2 Алкины – одна тройная связь Изомерия: Углеродного скелета Положения тройной
- 46. Скачать презентацию
























 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур
Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка Положение металлов в периодической системе химических элементов. Особенности строения их атомов
Положение металлов в периодической системе химических элементов. Особенности строения их атомов Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1
Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1 Роль хімії в пізнанні природи
Роль хімії в пізнанні природи Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Органикалық химияға кіріспе. Органикалық заттардың ерекшеліктері
Органикалық химияға кіріспе. Органикалық заттардың ерекшеліктері 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Супрамолекулярний контроль для дослідження реакційної здатності та каталізу
Супрамолекулярний контроль для дослідження реакційної здатності та каталізу Бета-окисление жирных кислот
Бета-окисление жирных кислот Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Кристалдану үдерісі және қолдланылатын аппараттар
Кристалдану үдерісі және қолдланылатын аппараттар Ауыр түсті металдар
Ауыр түсті металдар Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Цитохромы P-450, b-5
Цитохромы P-450, b-5 Метаморфогенные месторождения
Метаморфогенные месторождения Гидролиз солей
Гидролиз солей Природный и синтетический каучуки. Резина
Природный и синтетический каучуки. Резина Производство серной кислоты
Производство серной кислоты Распознавание химических соединений
Распознавание химических соединений