Содержание
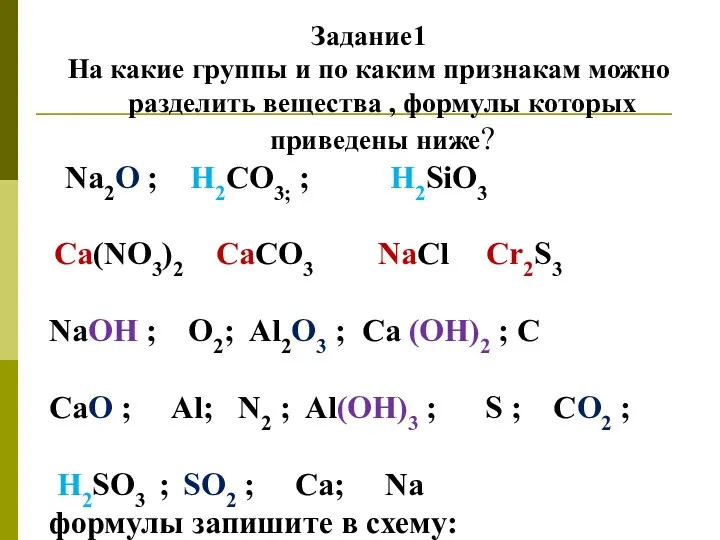
- 2. Задание1 На какие группы и по каким признакам можно разделить вещества , формулы которых приведены ниже?
- 3. СОЛИ , как производные кислот и оснований.
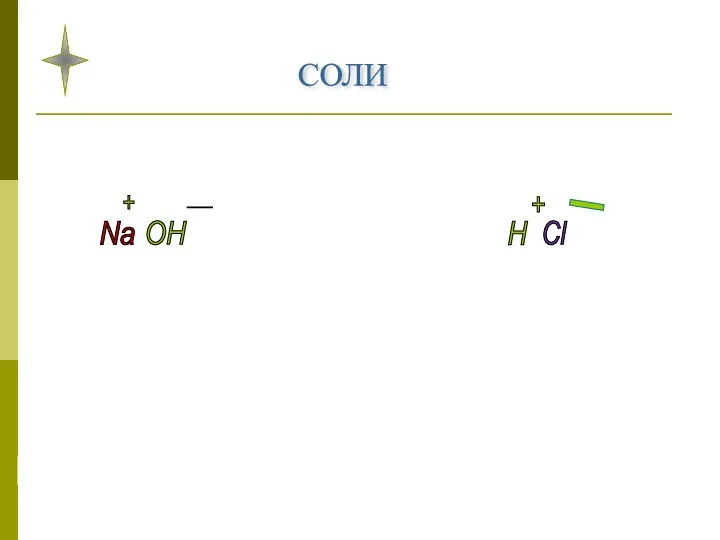
- 4. СОЛИ Na OH H Cl NaCl + - + _
- 5. Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
- 6. 3 задание. Определить : почему у солей разное количество кислотных остатков Дайте обоснованный ответ. NaNO3 Ca
- 7. 3 задание. Na+1 Ca+2 Al+3 Имеют разную степень окисления. (см. таблицу растворимости)
- 8. задание 4. Определить : почему у солей разное количество ионов металла? Дайте обоснованный ответ. NaNO3 Na
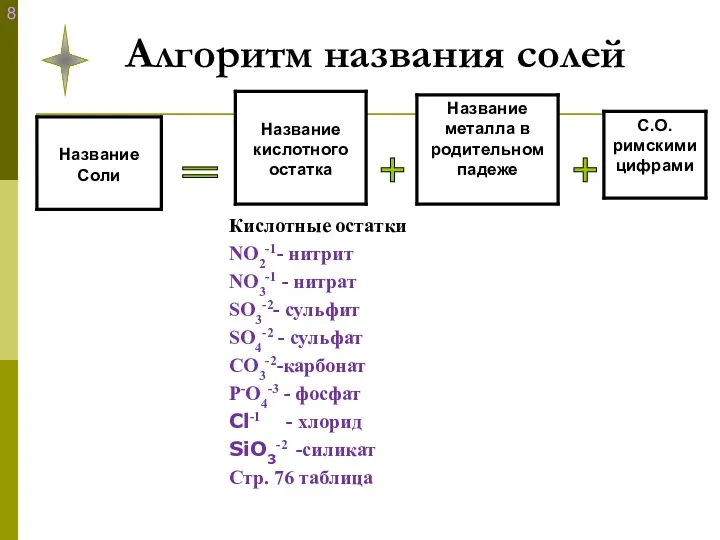
- 9. Так как кислотные остатки имеют свою степень окисления: (см. таблицу растворимости) NO2-1- нитрит NO3-1 - нитрат
- 10. Выведем общую формулу солей? Ме+n (К. О.-m)n
- 11. Алгоритм названия солей + + =
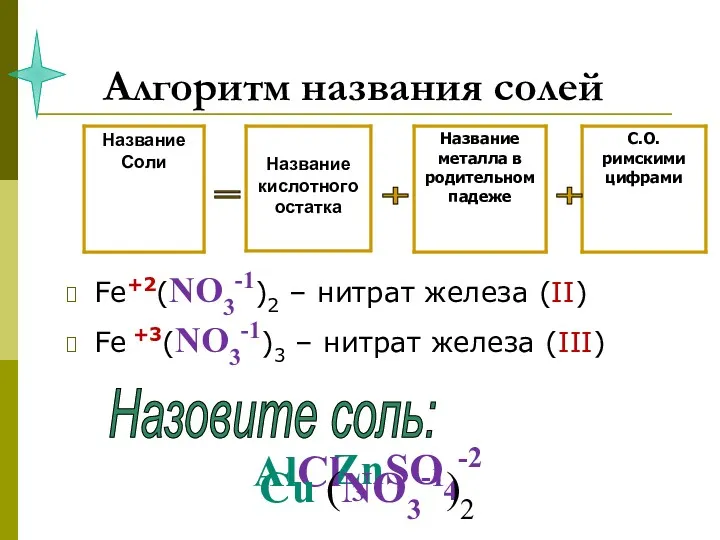
- 12. Алгоритм названия солей Fe+2(NO3-1)2 – нитрат железа (II) Fe +3(NO3-1)3 – нитрат железа (III) = +
- 13. задание 5. НАЗОВИТЕ СОЛИ NaCl Fe +2SO4 Al3(PO4)3 Ca(NO3)2 Cu+2CO3 Cr2+3S3 Na2SO4 Ba(NO3 )2
- 14. задание 5. НАЗОВИТЕ СОЛИ NaCl - хлорид натрия Fe +2SO4 - сульфат железа (II) Al3(PO4)3 –
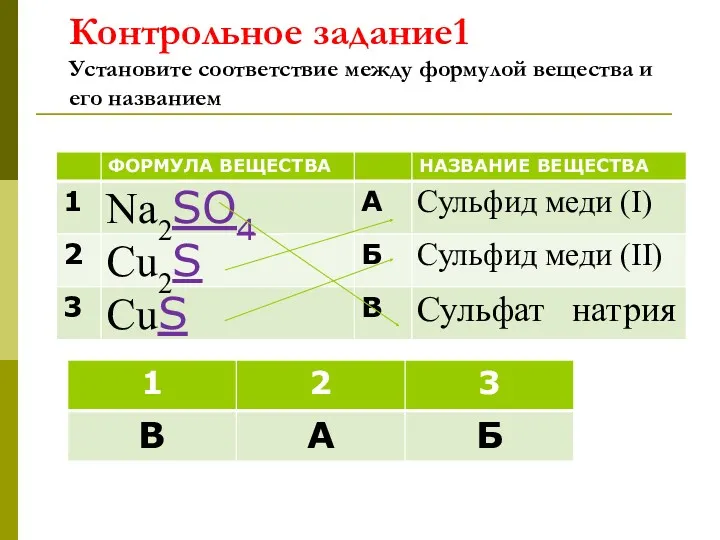
- 15. Контрольное задание1 Установите соответствие между формулой вещества и его названием
- 16. 2. Составление формул солей по их названиям.
- 17. 1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Алгоритм составления формул солей: Составить
- 18. 2. Над знаками химических элементов поставь их степень окисления. Пример: Fe SO4 +3 -2 Второй пункт
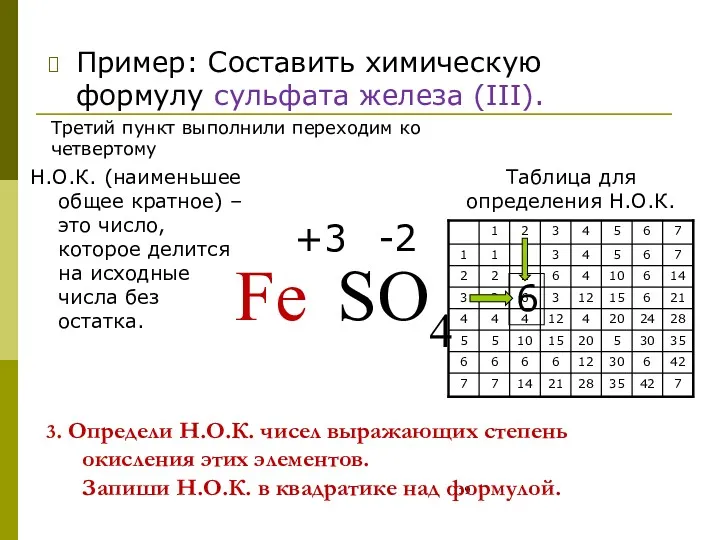
- 19. 3. Определи Н.О.К. чисел выражающих степень окисления этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример:
- 20. 4. Раздели Н.О.К. на степень окисления каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу сульфата
- 21. Составить формулу сульфата алюминия: (второй способ) Составьте формулы: Упр. 3 стр. 78 Al 2 + SO
- 22. Составьте формулу хлорида кальция СаCl2 Составьте формулу нитрата натрия NaNO3 Zn(SO4)2 Cu NO3 Составьте формулу сульфата
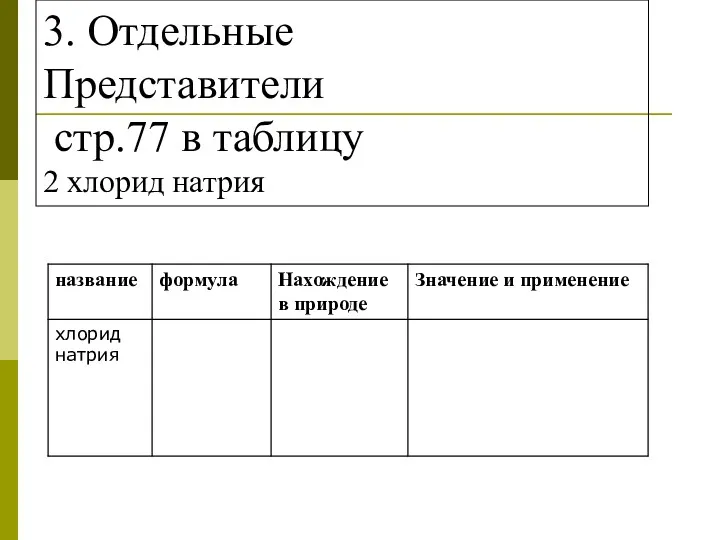
- 23. 3. Отдельные Представители стр.77 в таблицу 2 хлорид натрия
- 24. NaCl
- 25. "Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль” А.Е.Ферсман
- 26. За 4 года человек съедает пуд соли (в год человек с пищей потребляет 3-5,5 кг соли)
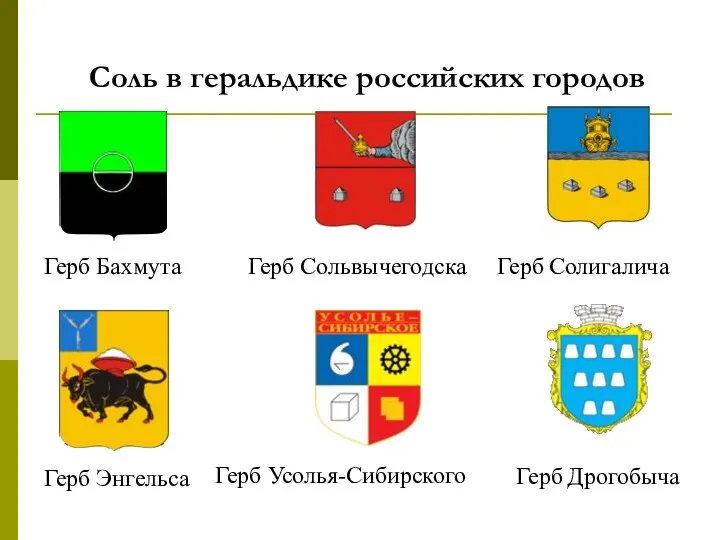
- 27. Соль в геральдике российских городов Герб Бахмута Герб Солигалича Герб Сольвычегодска Герб Энгельса Герб Усолья-Сибирского Герб
- 28. Добыча соли из соляных шахт из соленых озер
- 29. На озере Баскунчак ежегодно добывается около 5 млн. тонн соли
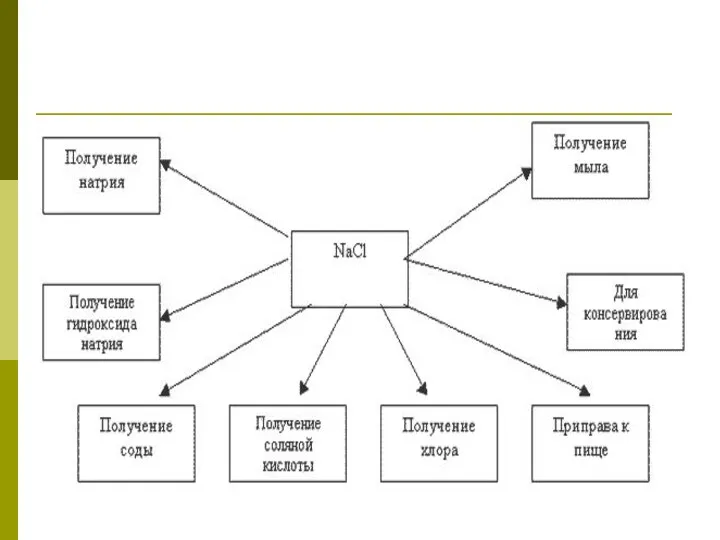
- 30. Применение NaCl
- 31. Д/З: CaCO3
- 32. Моллюски, раки, радиолярии, кораллы – все имеют известковый скелет
- 33. Большой Барьерный риф в Австралии
- 34. Меловые горы
- 35. Минералы карбоната кальция находятся в горных породах: Известняк Мел Мрамор Мрамор Мрамор Мрамор Травертин
- 36. Мрамор – строительный материал Единственное в России здание, полностью построенное из нешлифованного мрамора — железнодорожный вокзал
- 37. Д/З: Фосфат кальция - основа минералов фосфоритов и апатитов
- 38. 3.КЛАССИФИКАЦИЯ: а)по растворимости
- 39. Лабораторный опыт. №1 Определите растворимость солей Для этого: -прибавьте в первую пробирку к хлориду натрия 5-10
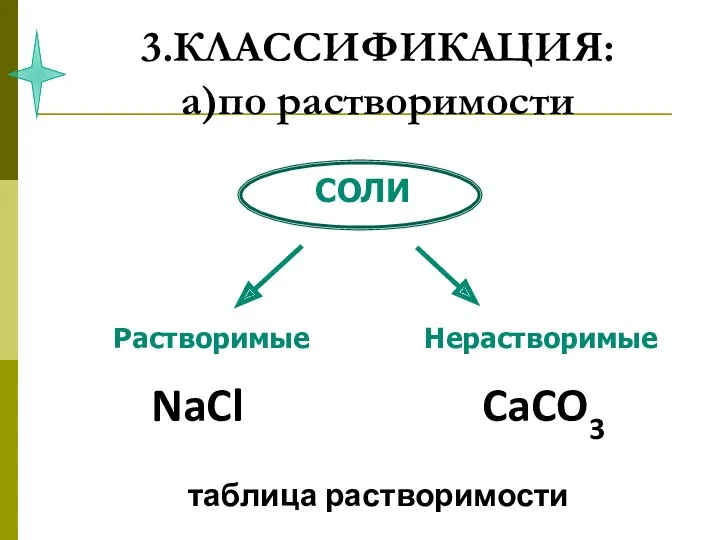
- 40. 3.КЛАССИФИКАЦИЯ: а)по растворимости NaCl CaCO3 таблица растворимости
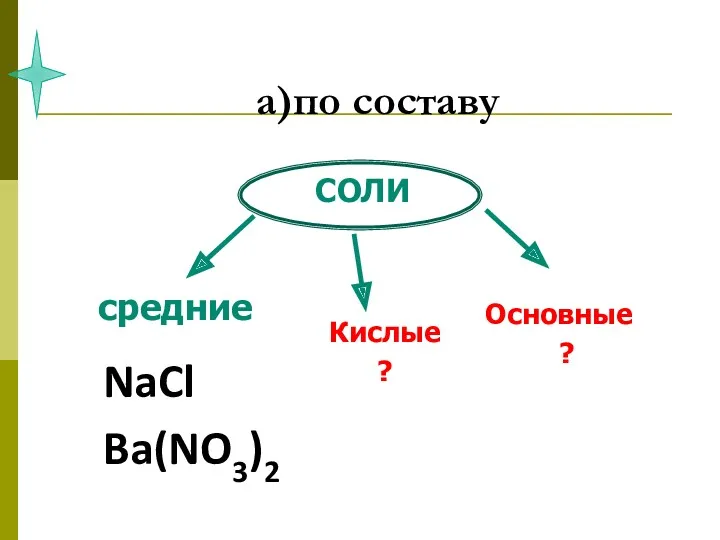
- 41. а)по составу
- 42. Лабораторный опыт. №2 Определите в какой из трех пробирок находятся кислота, в какой щелочь, в какой
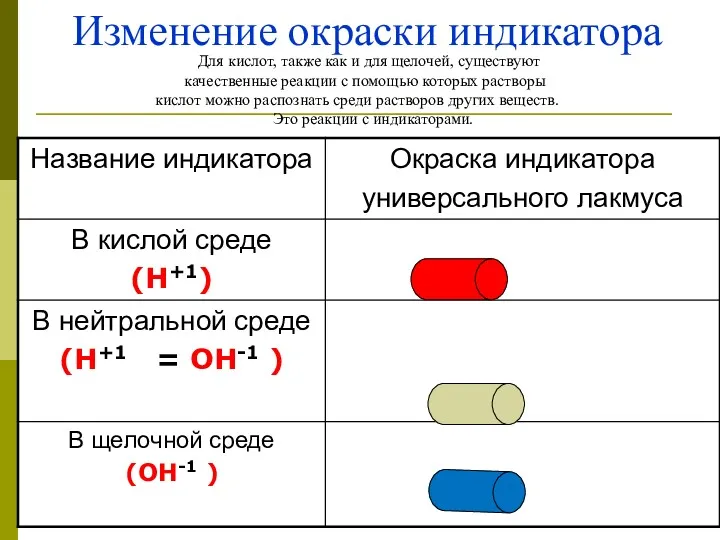
- 43. Изменение окраски индикатора Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых
- 44. Контрольное задание3 Ответте на вопросы: 1.Какая окраска индикатора в растворе хлорида натрия. Почему? 2.Раствор хлорида натрия.
- 45. а)по составу NaCl Ba(NO3)2
- 46. Подведем итоги?
- 47. Контрольное задание - итоговое Часть А (задания с выбором ответа) 1. Соли – это сложные вещества:
- 48. Контрольное задание - итоговое Часть В Выбери лишнее вещество и объясни почему? Игра « Третий лишний»
- 49. Контрольное задание - итоговое Часть А Г А Часть В объясни почему? 1. NaCl. т.к… 2.
- 50. Домашнее задание §,21 упр.3 стр. 78 Составить презентацию фосфата кальция или опорный конспект в форме таблицы
- 52. Скачать презентацию



































 Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Моносахариды, дисахариды
Моносахариды, дисахариды Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов Аналитическая химия
Аналитическая химия Обмен липидов
Обмен липидов Соли. Классификация
Соли. Классификация Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Классификация химических реакций (11 класс)
Классификация химических реакций (11 класс) Хімічні формули речовин
Хімічні формули речовин Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Обмен нуклеопротеинов
Обмен нуклеопротеинов Роль воды в химических реакциях
Роль воды в химических реакциях Понятие о единичных и симметрично-равных направлениях
Понятие о единичных и симметрично-равных направлениях Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов
Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов Медь и её соединения
Медь и её соединения Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы
Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы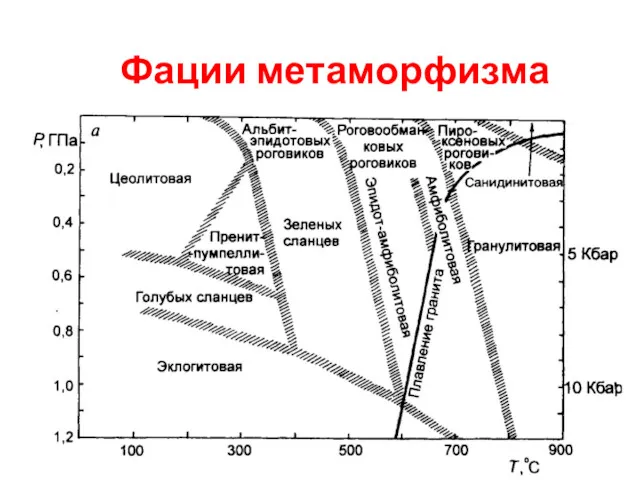 Фации метаморфизма
Фации метаморфизма Химическая связь 11 класс ионная связь
Химическая связь 11 класс ионная связь Химические формулы
Химические формулы Водород. Химический элемент
Водород. Химический элемент Кислород
Кислород Коллигативные свойства растворов
Коллигативные свойства растворов