Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1.
- 6. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
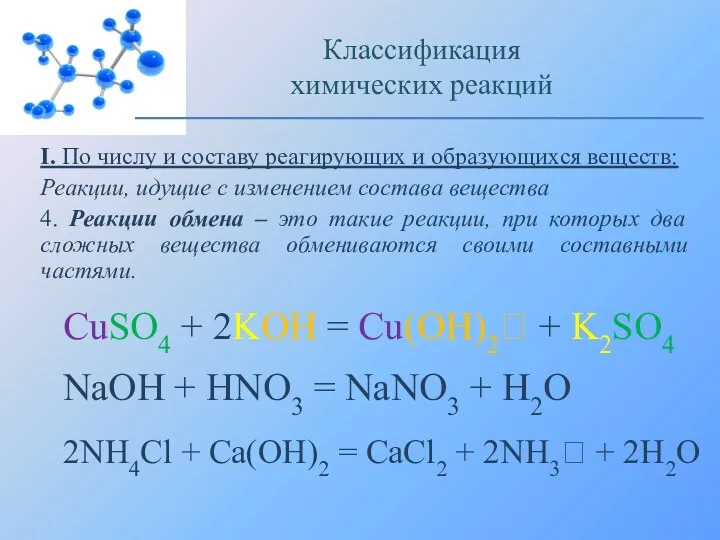
- 8. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
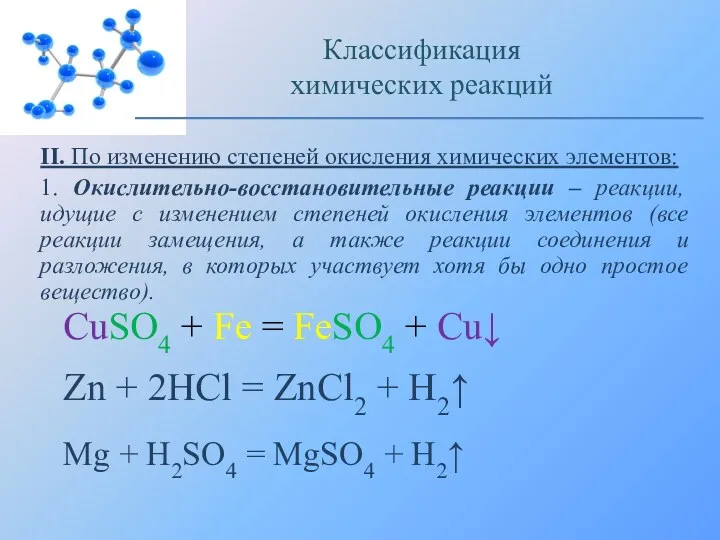
- 9. II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней
- 10. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
- 11. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций
- 12. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
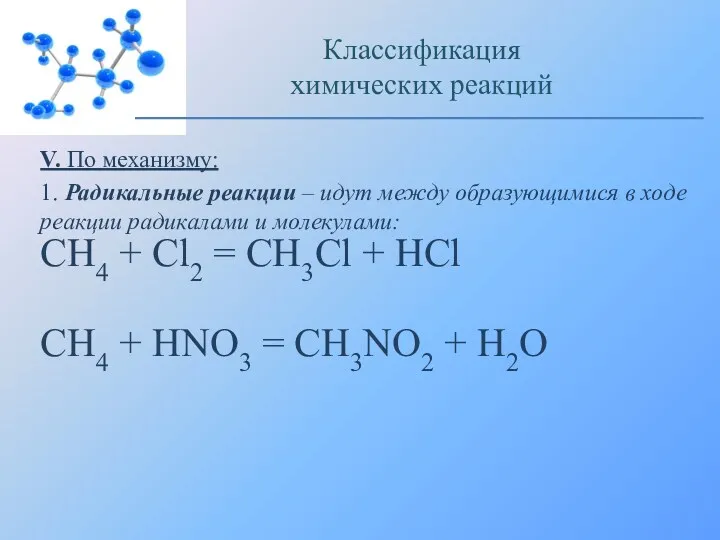
- 13. V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
- 14. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 15. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P +
- 16. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 +
- 17. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой
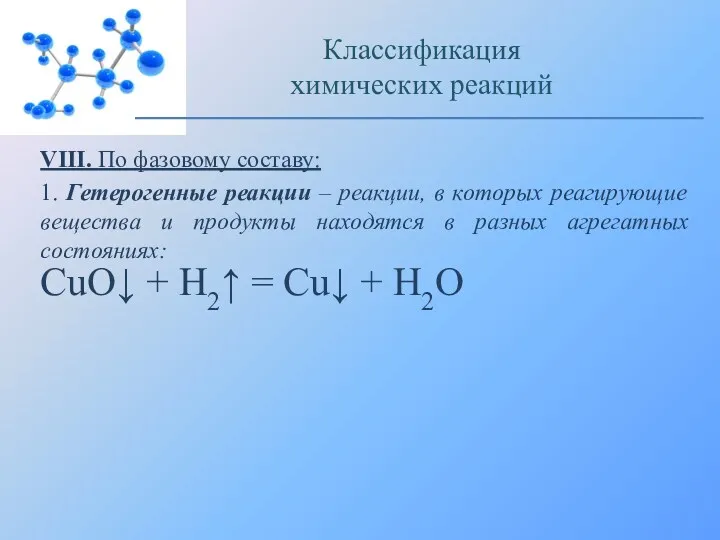
- 18. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 20. Скачать презентацию













 Классификация химических реакций
Классификация химических реакций Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Виды химической связи
Виды химической связи Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Основные виды химических связей
Основные виды химических связей Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Чистые вещества и смеси
Чистые вещества и смеси Геохимическая классификация элементов
Геохимическая классификация элементов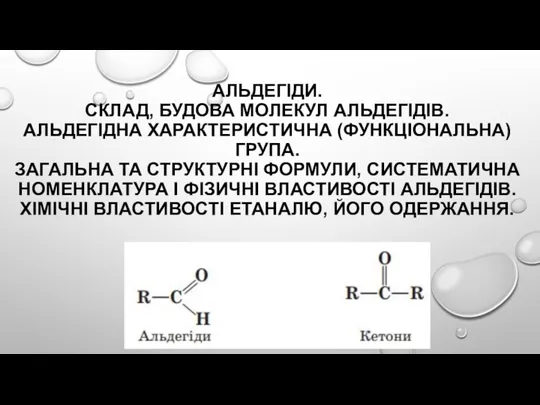 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Тепловой эффект химической реакции
Тепловой эффект химической реакции Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Водород. Положение в периодической системе
Водород. Положение в периодической системе Основные виды химических связей
Основные виды химических связей Центрифугирование в почвоведении
Центрифугирование в почвоведении Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Химия нефти и газа
Химия нефти и газа Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр Түсті металдар
Түсті металдар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Типы химических реакций в органической химии
Типы химических реакций в органической химии Трансмиссионные масла
Трансмиссионные масла Тепловой эффект химических реакций
Тепловой эффект химических реакций Титриметрический метод анализа
Титриметрический метод анализа Синтетические моющие средства. Использование их в повседневной жизни
Синтетические моющие средства. Использование их в повседневной жизни Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены