Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По тепловому
- 4. Соединение Разложение Замещение Обмен По числу и составу реагирующих и образующихся веществ
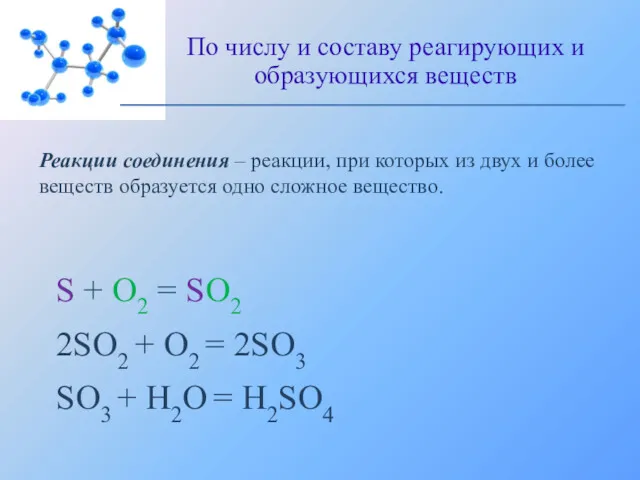
- 5. Реакции соединения – реакции, при которых из двух и более веществ образуется одно сложное вещество. По
- 6. Горение серы в кислороде (пример реакции соединения): По числу и составу реагирующих и образующихся веществ
- 7. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
- 8. Получение кислорода из перманганата калия (пример реакции разложения): По числу и составу реагирующих и образующихся веществ
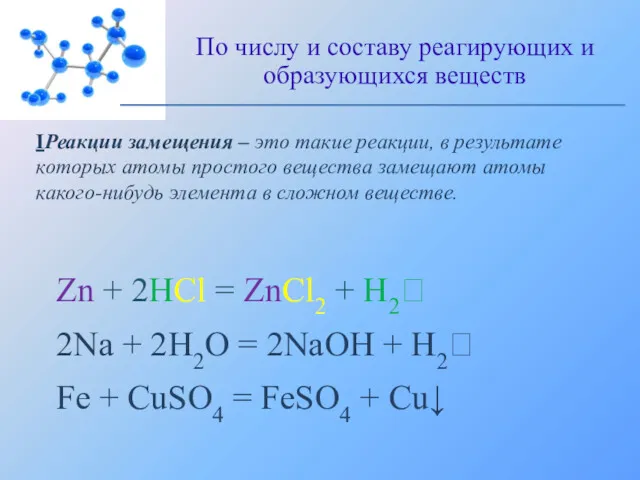
- 9. IРеакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента
- 10. Взаимодействие натрия с водой (пример реакции замещения): По числу и составу реагирующих и образующихся веществ
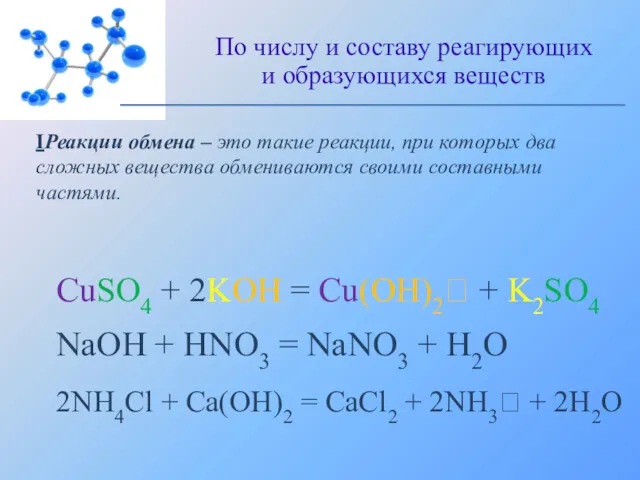
- 11. IРеакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями. По
- 12. Взаимодействие сульфата меди (II) с гидроксидом калия (пример реакции обмена) По числу и составу реагирующих и
- 13. Окислительно-восстановительные реакции Не окислительно-восстановительные реакции По изменению степеней окисления химических элементов
- 14. 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов (все реакции замещения, а также
- 15. Взаимодействие железа с медным купоросом (пример окислительно-восстановительной реакции): По изменению степеней окисления химических элементов
- 16. 1. Экзотермические реакции протекают с выделением энергии: По тепловому эффекту 4P + 5O2 = 2P2O5 +
- 17. Горение фосфора в кислороде (пример экзотермической реакции): По тепловому эффекту
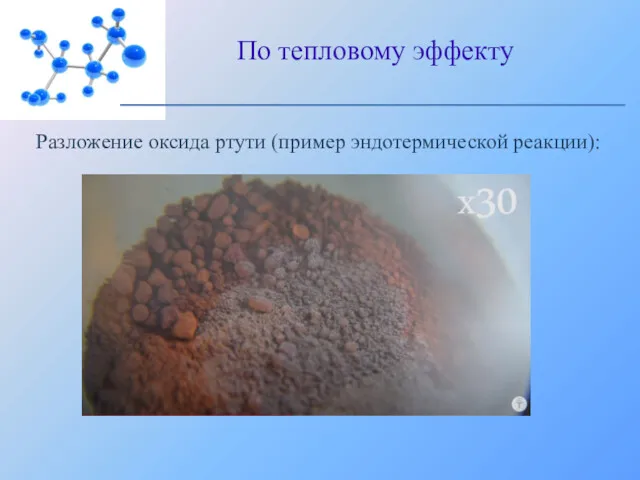
- 18. 2. Эндотермические реакции протекают с поглощением энергии: По тепловому эффекту 2HgO = 2Hg↓ + O2↑ -
- 19. Разложение оксида ртути (пример эндотермической реакции): По тепловому эффекту
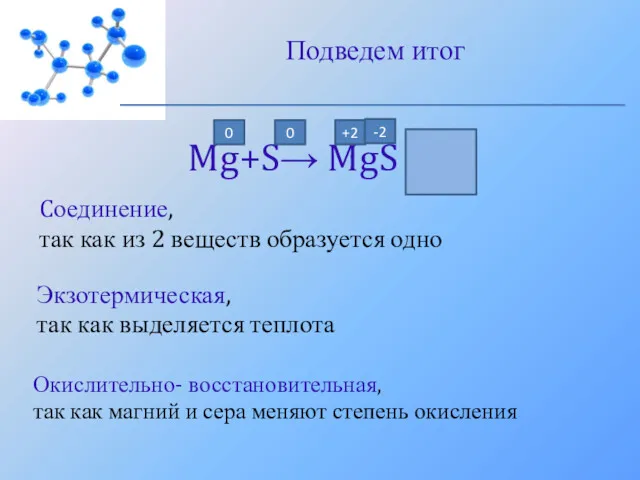
- 20. Подведем итог Mg+S→ MgS +Q Cоединение, так как из 2 веществ образуется одно Экзотермическая, так как
- 21. Подведем итог
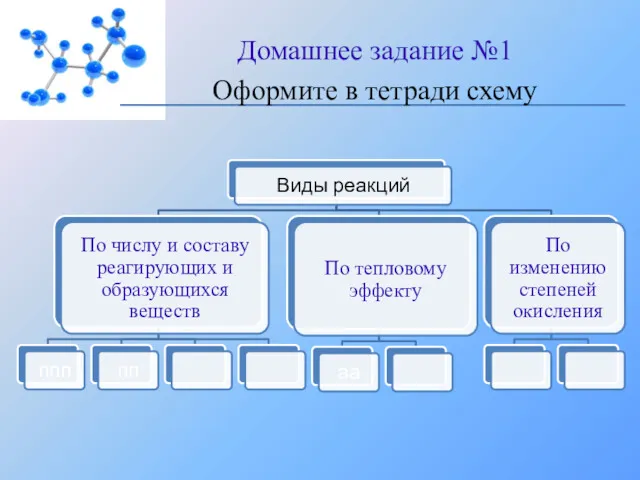
- 22. Домашнее задание №1 Оформите в тетради схему
- 23. Домашнее задание №2 Для реакции СаСО3=СаО + СО2 – Q Приведите все 3 классификации, опираясь на
- 25. Скачать презентацию
















 Комплексные соединения
Комплексные соединения Химический элемент гелий
Химический элемент гелий Минералы свинца
Минералы свинца Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Водород. Химический элемент
Водород. Химический элемент Подгруппа Азота
Подгруппа Азота Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Химический элемент фтор
Химический элемент фтор Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Гальваникалық элементтер
Гальваникалық элементтер Титриметрический метод анализа
Титриметрический метод анализа Волокна. Классификация волокон
Волокна. Классификация волокон Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов Свинец (Pb)
Свинец (Pb) Растворы. Лекция №5
Растворы. Лекция №5 Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Электролитическая диссоциация
Электролитическая диссоциация Азотсодержащие соединения
Азотсодержащие соединения Кристалогідрати. Номенклатура, найважливіші кристалогідрати та їх застосування
Кристалогідрати. Номенклатура, найважливіші кристалогідрати та їх застосування Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Почему мыло пенится
Почему мыло пенится Химическая природа косметического сырья. Простые и сложные вещества
Химическая природа косметического сырья. Простые и сложные вещества Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Обобщающий урок по теме: Металлы
Обобщающий урок по теме: Металлы