Содержание
- 2. ПЛАН ЛЕКЦИИ Определение окислительно-восстановительных реакций Виды окислительно-восстановительных реакций Важнейшие окислители и восстановители Окислительно-восстановительная двойственность Метод электронного
- 3. Окислительно-восстановительные реакции– это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами
- 4. Для того чтобы рассчитать степень окисления любого элемента, необходимо пользоваться следующими правилами: Степень окисления атомов в
- 5. Реакции окисления-восстановления делятся на следующие типы: межмолекулярного окисления-восстановления; самоокисления-самовосстановления (диспропорционирования) внутримолекулярного окисления – восстановления.
- 6. Реакции межмолекулярного окисления-восстановления – это реакции, когда окислитель находится в одной молекуле, а восстановитель – в
- 7. Реакции самоокисления-самовосстановления (реакции диспропорционирования) – это реакции, в ходе которых часть общего количества элемента окисляется, а
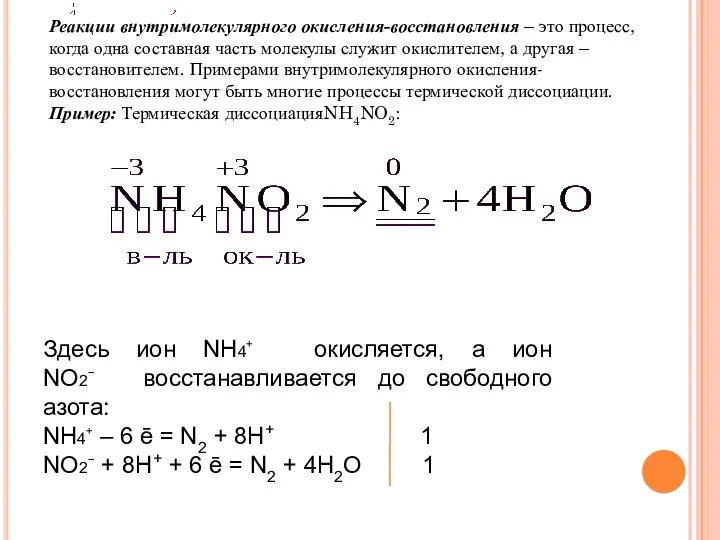
- 8. Реакции внутримолекулярного окисления-восстановления – это процесс, когда одна составная часть молекулы служит окислителем, а другая –
- 9. К типичным окислителям относят: 1) Элементарные вещества – Cl2,Br2,F2,I2,O,O2. 2) Соединения, в которых элементы проявляют высшую
- 10. К типичным восстановителямотносят: 1) Элементарные вещества – металлы (наибольшая восстановительная способность у щелочных металлов), Н2, С,
- 11. Окислительно-восстановительная двойственность. Соединения высшей степени окисления, присущей данному элементу, могут в окислительно-восстановительных реакциях выступать только в
- 12. Метод электронного баланса Fe0– 3ē =Fe+3 4 - процесс окисления; O2+ 4ē = 2O–2 3 -
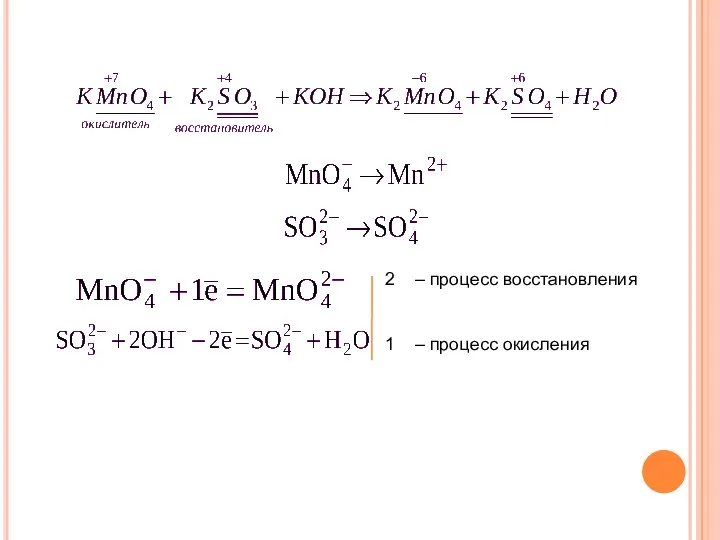
- 13. Метод полуреакций применяется для уравнивания реакций, протекающих в растворах электролитов. В таких случаях в реакциях принимают
- 14. Кислая среда 2 – процесс восстановления 5 –процесс окисления
- 15. 2 – процесс восстановления 1 – процесс окисления
- 17. Скачать презентацию












 Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов
Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Правила техники безопасности при работе в кабинете химии
Правила техники безопасности при работе в кабинете химии Титан. Хром
Титан. Хром Основные разделы химии
Основные разделы химии Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Ионная хроматография
Ионная хроматография Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Щелочные металлы. 9 класс
Щелочные металлы. 9 класс История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства
Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства Электрохимические процессы
Электрохимические процессы Alkynes
Alkynes Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Аммиак
Аммиак Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические свойства кислот
Химические свойства кислот Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей