Содержание
- 2. Алгоритм розв’язування задач: Прочитати уважно умову задачі та записати скорочену умову. Скласти рівняння хімічної реакції (в
- 3. Алгоритм розв’язування задач: 4. Під формулами записати молярну масу чи молярний об’єм (для газуватих речовин), враховуючи
- 4. Основні фізико-хімічні величини та одиниці їх вимірювання: Маса – m – г, кг Молярна маса –
- 5. Задача № 1 Розрахуйте масу фосфор (V) оксиду, який утворюється при взаємодії фосфору масою 3,72 г
- 6. Задача № 2 Магній кількістю речовини 1,5 моль спалили в кисні. Визначте масу добутого магній оксиду.
- 7. Задача № 3 До літій оксиду масою 6 г додали надлишок води. Обчисліть масу літій гідроксиду,
- 8. Задача № 4 Визначте кількість речовини вуглекислого газу, який утвориться при згорянні 3 г вуглецю.
- 9. Задача № 5 Обчислити об’єм водню (н.у.), який виділяється внаслідок взаємодії хлоридної кислоти з магнієм кількістю
- 10. Задача 1. Яка кількість речовини лугу утвориться при взаємодії 5 моль кальцій оксиду з водою? Відповідь:
- 11. Задача . Який об’єм ( н.у)водню виділиться при взаємодії 227,5 г цинку з розчином сульфатної кислоти
- 12. Задача 3. Обчисліть масу солі, що утвориться при взаємодії 4 г купрум (ІІ) оксиду з надлишком
- 13. Задача 4. Яка маса ортофосфатної кислоти утворилася, якщо у реакцію з водою вступив фосфор (V) оксид
- 15. Скачать презентацию












 Углерод. Аллотропные модификации углерода
Углерод. Аллотропные модификации углерода Поделочные камни
Поделочные камни Удобрения и их классификация
Удобрения и их классификация Единство химической организации живых организмов
Единство химической организации живых организмов Токсикология пестицидов
Токсикология пестицидов Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Азотсодержащие соединения
Азотсодержащие соединения Занимательная химия. Химический элемент. 8 класс
Занимательная химия. Химический элемент. 8 класс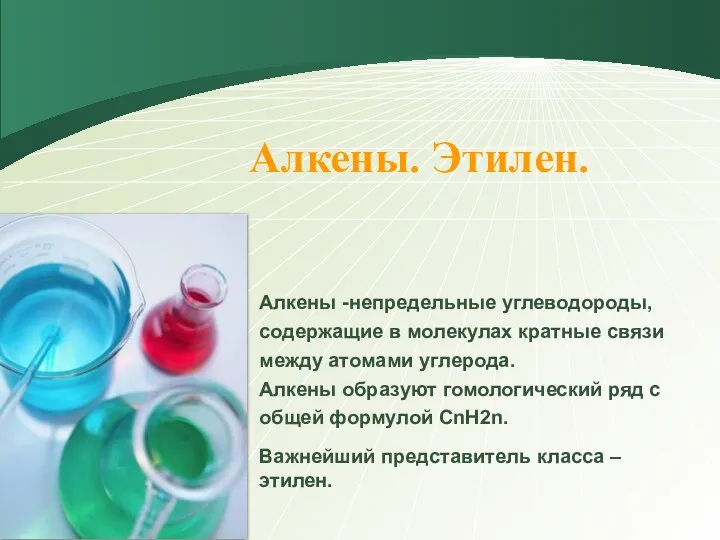 Алкены. Этилен
Алкены. Этилен Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Потенциометрия
Потенциометрия Подгруппа меди. Элементы 11 группы (Cu,Ag,Au)
Подгруппа меди. Элементы 11 группы (Cu,Ag,Au) Карбонові кислоти
Карбонові кислоти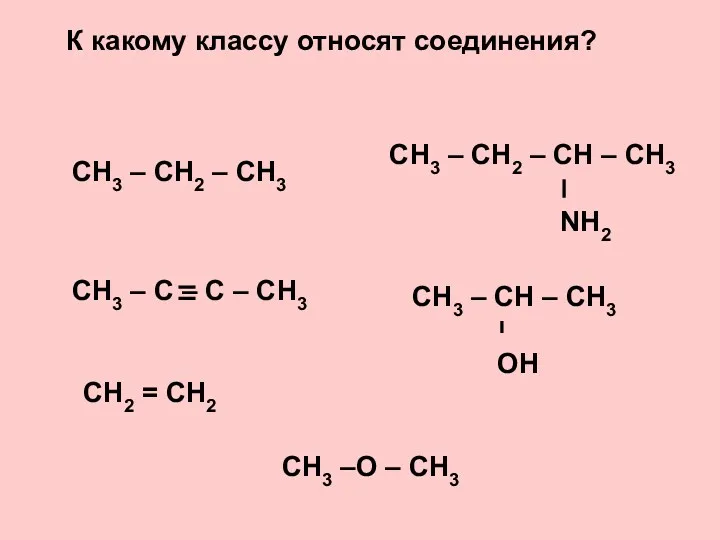 16_OP_05_Alkany
16_OP_05_Alkany Строение атома
Строение атома Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Химические свойства металлов
Химические свойства металлов Пурины. Строение пурина
Пурины. Строение пурина Гидролиз. Классификация солей
Гидролиз. Классификация солей Свойства минералов
Свойства минералов Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Периодический закон и строение атома
Периодический закон и строение атома Предмет и история геохимии
Предмет и история геохимии Загадочный Менделеев
Загадочный Менделеев Простые и сложные вещества
Простые и сложные вещества