Содержание
- 2. Н3С СООН Н3С СООН Н3С СООН 3 6 6 Н3С СООН 3 Высшие жирные кислоты ПНЖК
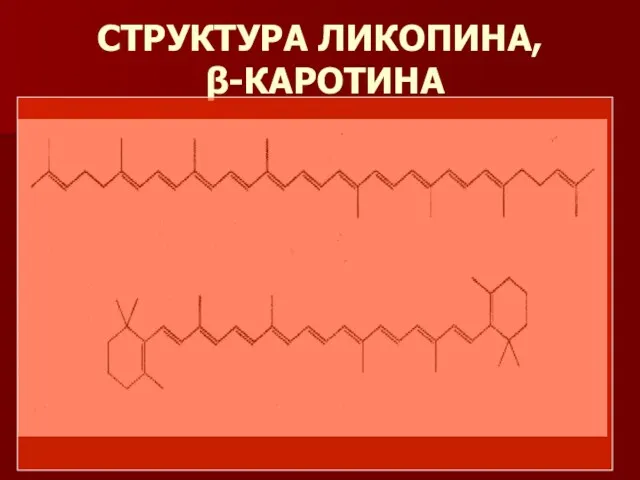
- 3. СТРУКТУРА ЛИКОПИНА, β-КАРОТИНА
- 4. ЛИКОПИН ОПРЕДЕЛЯЕТ ЦВЕТ ТОМАТОВ
- 5. Бета-каротин определяет окраску моркови
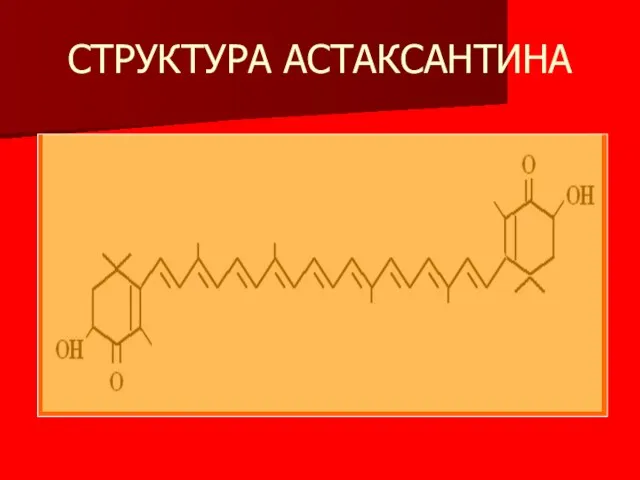
- 6. СТРУКТУРА АСТАКСАНТИНА
- 7. АСТАКСАНТИН ОПРЕДЕЛЯЕТ ОКРАСКУ КРАБОВ, КРЕВЕТОК КРАСНОЙ РЫБЫ
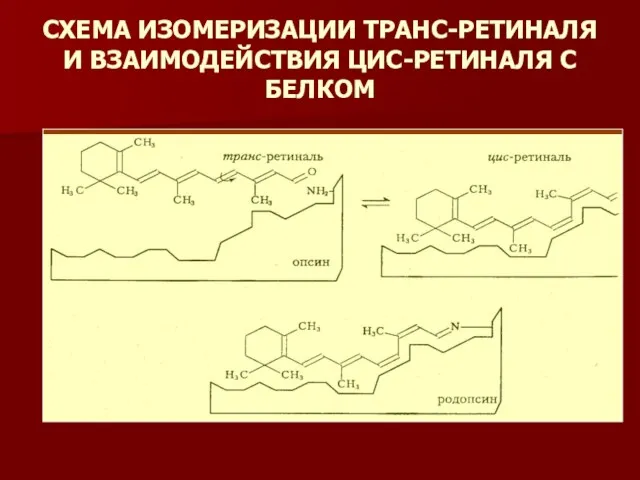
- 8. СХЕМА ИЗОМЕРИЗАЦИИ ТРАНС-РЕТИНАЛЯ И ВЗАИМОДЕЙСТВИЯ ЦИС-РЕТИНАЛЯ С БЕЛКОМ
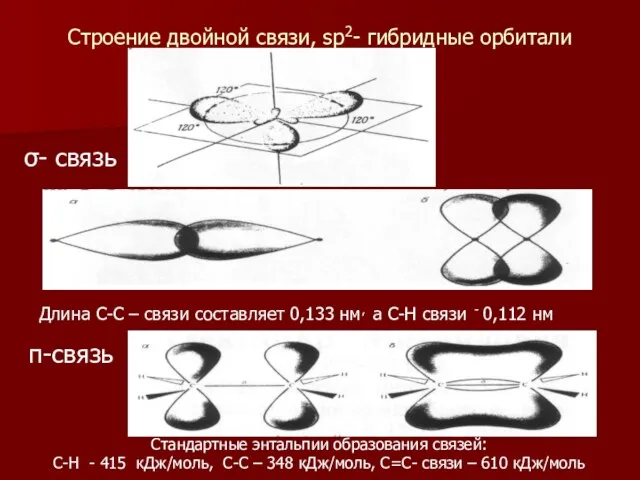
- 9. Строение двойной связи, sp2- гибридные орбитали Длина С-С – связи составляет 0,133 нм, а С-Н связи
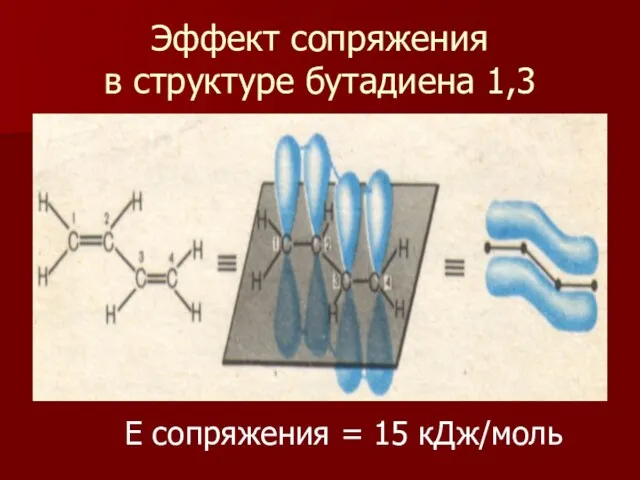
- 10. Эффект сопряжения в структуре бутадиена 1,3 Е сопряжения = 15 кДж/моль
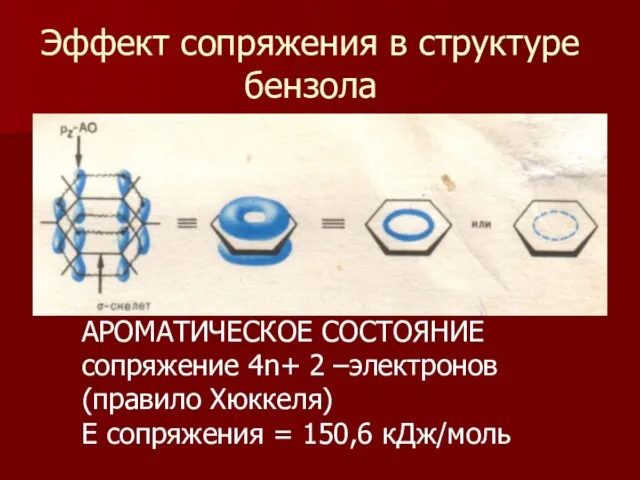
- 11. Эффект сопряжения в структуре бензола АРОМАТИЧЕСКОЕ СОСТОЯНИЕ сопряжение 4n+ 2 –электронов (правило Хюккеля) Е сопряжения =
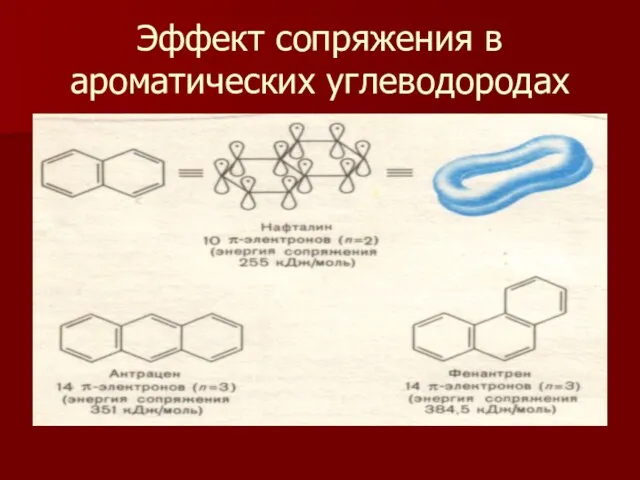
- 12. Эффект сопряжения в ароматических углеводородах
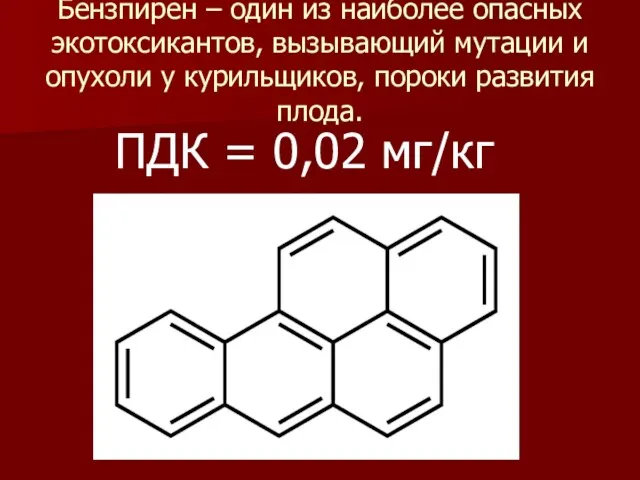
- 13. Бензпирен – один из наиболее опасных экотоксикантов, вызывающий мутации и опухоли у курильщиков, пороки развития плода.
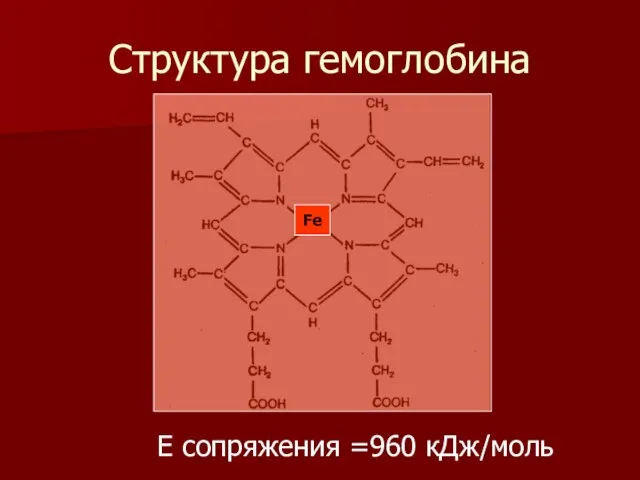
- 14. Структура гемоглобина Fe Е сопряжения =960 кДж/моль
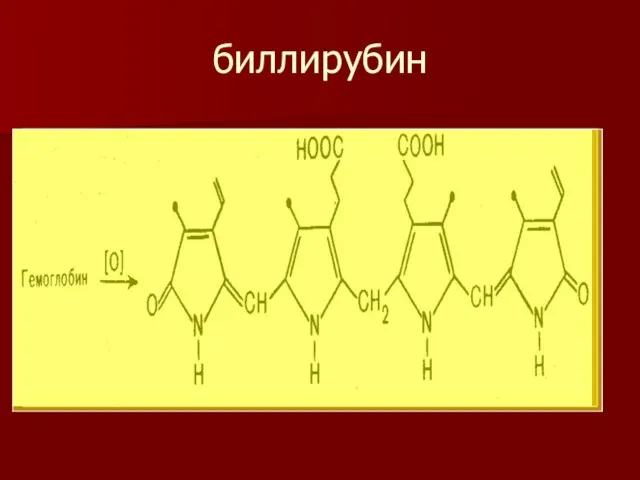
- 15. биллирубин
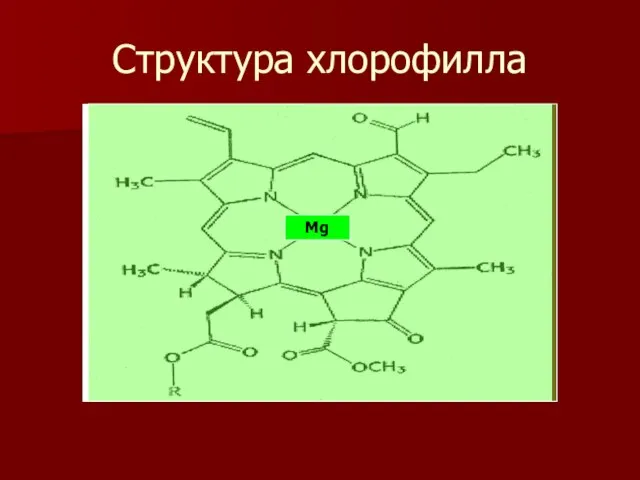
- 16. Структура хлорофилла Mg
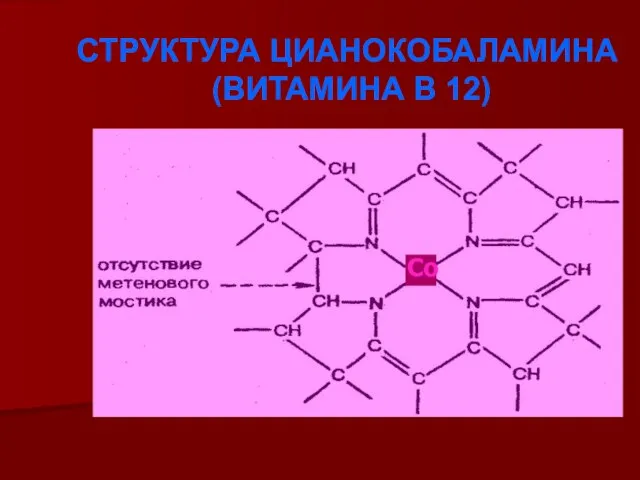
- 17. СТРУКТУРА ЦИАНОКОБАЛАМИНА (ВИТАМИНА В 12) Со
- 18. РАЗНООБРАЗИЕ ОКРАСОК,ОБУСЛОВЛЕННЫХ СОДЕРЖАНИЕМ СОПРЯЖЕННЫХ ПОЛИЕНОВ
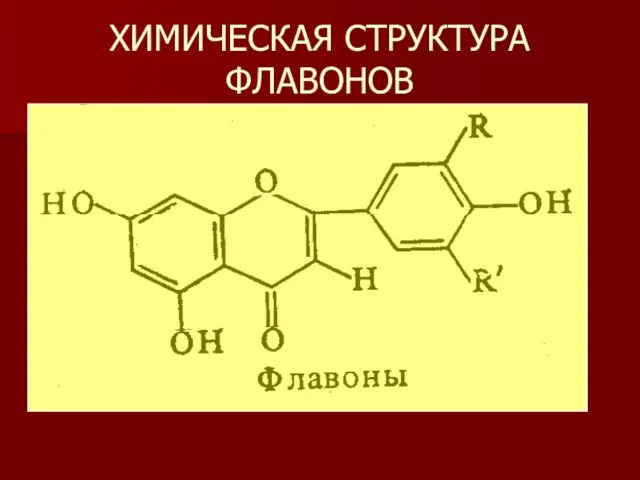
- 19. ХИМИЧЕСКАЯ СТРУКТУРА ФЛАВОНОВ
- 21. Понятие реакционного центра. В ходе биохимических и химических процессов превращению подвергается не вся молекула, а лишь
- 22. Типы разрыва связи Свободнорадикальные частицы образуются при гомолитическом разрыве ковалентной связи Е •|• Y → E•
- 23. Природа активных частиц Свободнорадикальные частицы (имеют неспаренный или валентный электрон) (ОH•, Br •,Cl •, CH3 •,
- 24. Классификация химических реакций 1. По результату химического взаимодействия. Различают реакции замещения, присоединения, элиминирования, окисления, восстановления, кислотно-основные
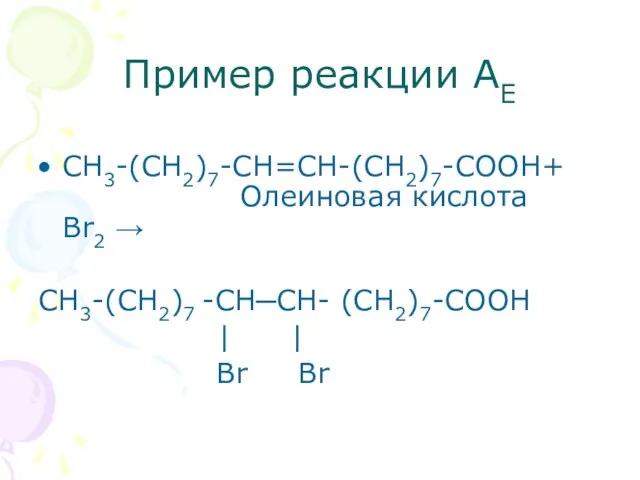
- 25. Пример реакции АЕ СН3-(СН2)7-СН=СН-(СН2)7-СООН+ Олеиновая кислота Br2 → СН3-(СН2)7 -СН─СН- (СН2)7-СООН | | Br Br
- 26. Реакции электрофильного присоединения Субстратом реакций AE являются алкены, алкины, реакции протекают по реакционному центру, представляющему собой
- 27. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (Лайнус Поллинг, 1932 г.) Электроотрицательность – это способность
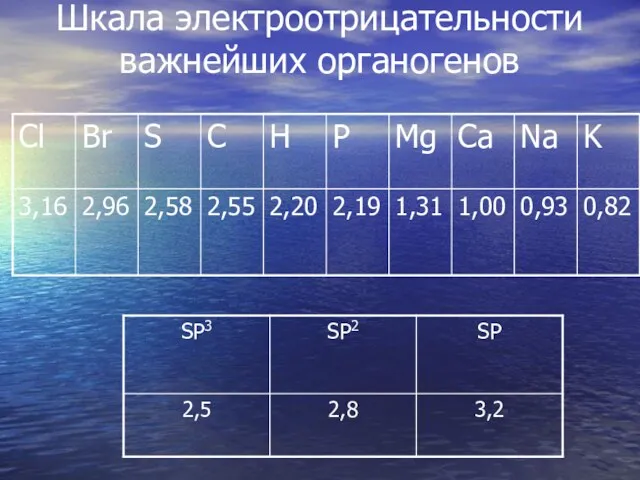
- 28. Шкала электроотрицательности важнейших органогенов
- 29. ИНДУКТИВНЫЙ ЭФФЕКТ Смещение электронной плотности по цепи σ-связей под влиянием заместителя называется индуктивным эффектом ( J
- 30. Электронные индуктивные эффекты заместителей δ+++ δ++ δ+ δ- -J : R-CH2→CH2→CH2→X X= -OH; -NO2; –COOH; -
- 31. МЕЗОМЕРНЫЙ ЭФФЕКТ Мезомерным эффектом называют передачу влияния заместителя в сопряженной системе (смещение электронной плотности в системе
- 32. ПРИРОДА ЗАМЕСТИТЕЛЕЙ Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект, + М, называются
- 33. Природа заместителей Заместители, оттягивающие электронную плотность из сопряженной системы, проявляют отрицательный мезомерный эффект, -М, называются ЭЛЕКТРОНОАКЦЕПТОРАМИ
- 34. Лекция № 2 КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 35. Кислотность и основность - важные свойства соединений, определяющие их фундаментальные физико-химические и биологические свойства. Ферментативные реакции
- 36. Кислотно-основные взаимодействия А-Н + :В ↔ А- + В-Н кислота основание сопряженное сопряженная основание кислота По
- 37. [НСОО-]×[Н3О+] К= [НСООН]×[Н2О] Ка = К×[Н2О] [НСОО-]×[Н3О+] Ка= [НСООН]
- 38. Чем ниже кислотность, тем выше рКа Ка = 1,75×10-5 рКа = -lg Ка = 4,75
- 39. КИСЛОТНОСТЬ И ОСНОВНОСТЬ СВЯЗАНЫ СО ВЗАИМНЫМ ВЛИЯНИЕМ АТОМОВ В МОЛЕКУЛАХ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ, с понятием ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (Лайнус
- 40. Сила кислоты определяется стабильностью образующихся ионов, которая определяется: 1.Электроотрицательнью элементов
- 41. ПОЛЯРИЗУЕМОСТЬ 2. Влияние электронных эффектов δ- δ+ рКа=18 рКа=10 рКа=12
- 42. Поляризуемость Для S-H кислот преобладающим фактором является поляризуемость. Атомы серы больше по размеру и имеют вакантные
- 43. Кислотность тиолов выше, чем кислотность спиртов R-S-H + NaOH → R-S-Na + H2O R-O-H + NaOH
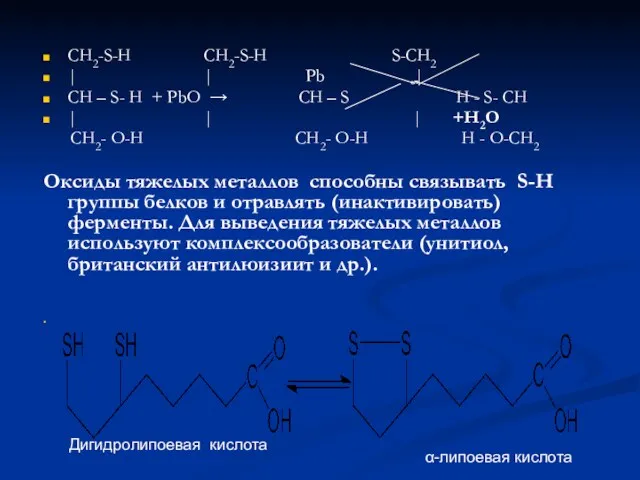
- 44. CH2-S-H CH2-S-H S-CH2 | | Pb | CH – S- H + PbO → CH –
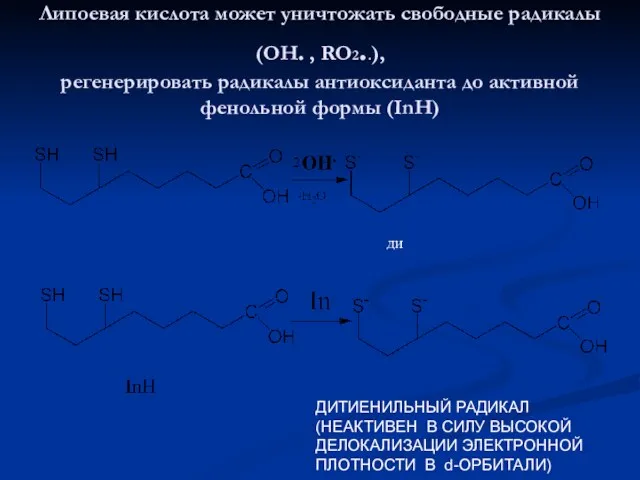
- 45. Липоевая кислота может уничтожать свободные радикалы (ОН. , RO2..), регенерировать радикалы антиоксиданта до активной фенольной формы
- 46. Атомы хлора выполняют роль электроноакцепторов ( - J ) СCl3←СООН > Cl←СH2 ←СООН >СH3→СООН pKa =
- 47. Основность –способность принимать и удерживать протоны Для образования ковалентной связи с протоном Н+ органические основания должны
- 48. Сравнительная оценка основных свойств Величина основности определяется теми же факторами, что и кислотность, но действие этих
- 49. Основания образуют соли с кислотами CH3→ NH2 + HCl → [CH3→ N+H3 ] Cl- хлорид метиламмония
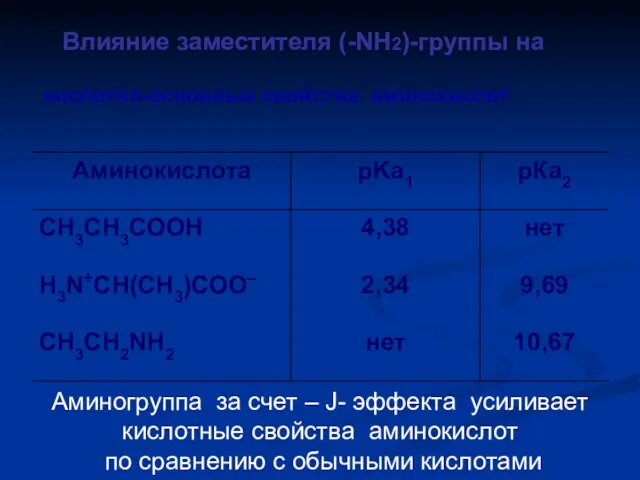
- 50. кислотно-основные свойства аминокислот Влияние заместителя (-NH2)-группы на Аминогруппа за счет – J- эффекта усиливает кислотные свойства
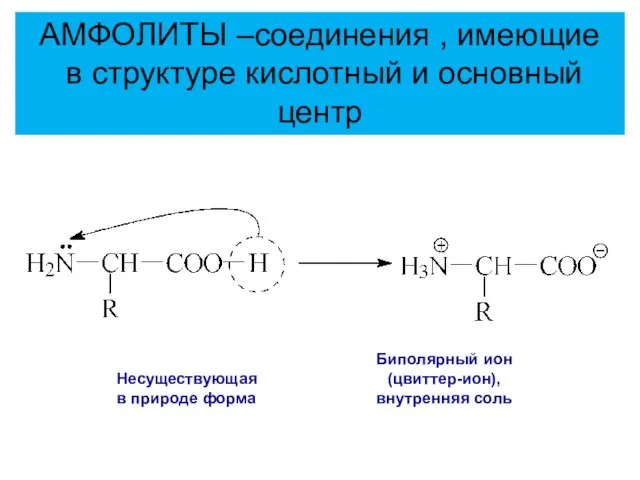
- 51. Несуществующая в природе форма Биполярный ион (цвиттер-ион), внутренняя соль АМФОЛИТЫ –соединения , имеющие в структуре кислотный
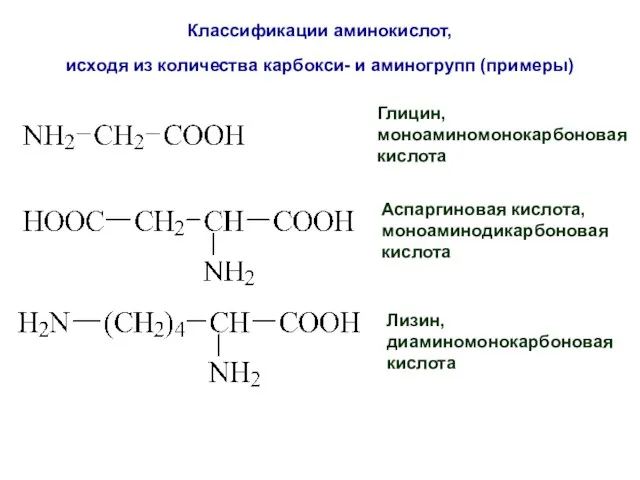
- 52. Классификации аминокислот, исходя из количества карбокси- и аминогрупп (примеры) Глицин, моноаминомонокарбоновая кислота Аспаргиновая кислота, моноаминодикарбоновая кислота
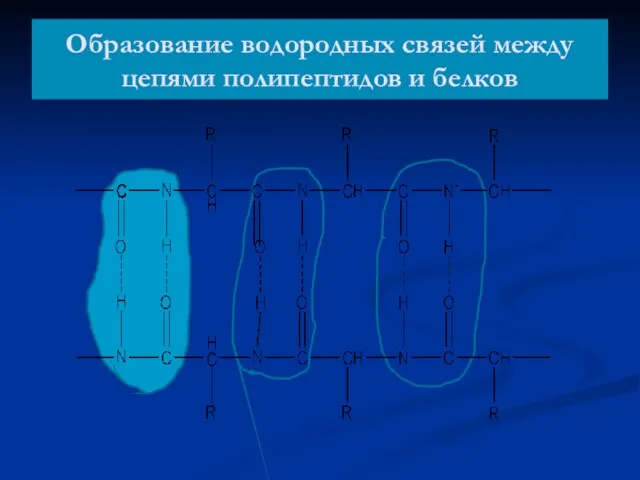
- 53. Образование водородных связей между цепями полипептидов и белков
- 55. Скачать презентацию




















![[НСОО-]×[Н3О+] К= [НСООН]×[Н2О] Ка = К×[Н2О] [НСОО-]×[Н3О+] Ка= [НСООН]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/431199/slide-36.jpg)










 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей