Содержание
- 2. Предшественники Д. И. Менделеева 1. Й. Я. Берцелиус ( шведский учёный) классифицировал все элементы на металлы
- 3. Свойства гидроксида цинка Взаимодействие гидроксида цинка с соляной кислотой: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
- 4. Предшественники Д. И. Менделеева 2. И. В. Дёберейнер ( немецкий химик) в 1829 г. предпринял первую
- 5. Предшественники Д. И. Менделеева 3. А. Бегье де Шанкуртуа (профессор Парижской высшей школы) в 1862 г.
- 6. Предшественники Д. И. Менделеева 4. Д. Ньюлендс (английский учёный) в 1865 г. расположил элементы в порядке
- 7. Предшественники Д. И. Менделеева 5. Л. Мейер (немецкий химик) в 1864 г. расположил химические элементы в
- 8. С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si,
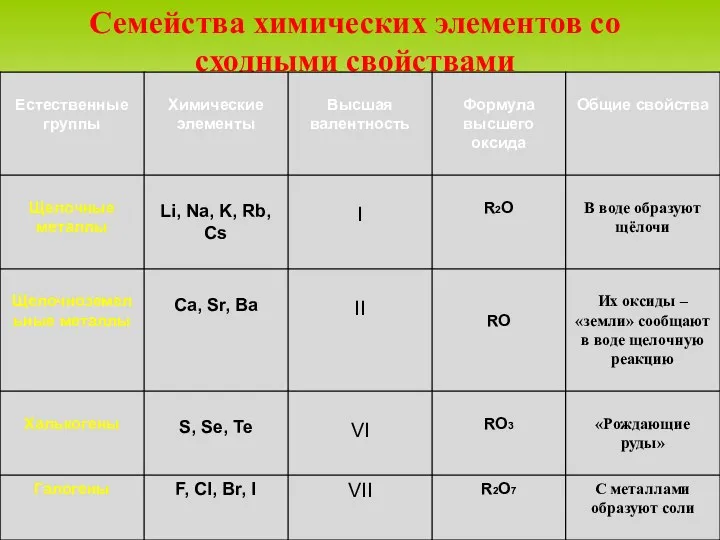
- 9. Семейства химических элементов со сходными свойствами
- 10. Вывод Классификация химических элементов до Д. И. Менделеева была не точной, не научной, не совершенной, так
- 11. Распределите по группам следующие оксиды: Na2O, CO2, P2O5, Cr2O3, ZnO, SO2, CaO, BeO, Ai2O3, CuO. Распределите
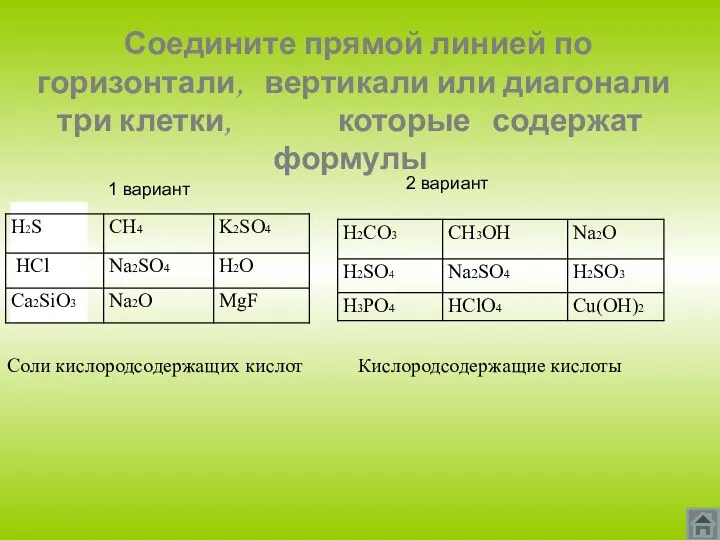
- 12. Соедините прямой линией по горизонтали, вертикали или диагонали три клетки, которые содержат формулы 1 вариант 2
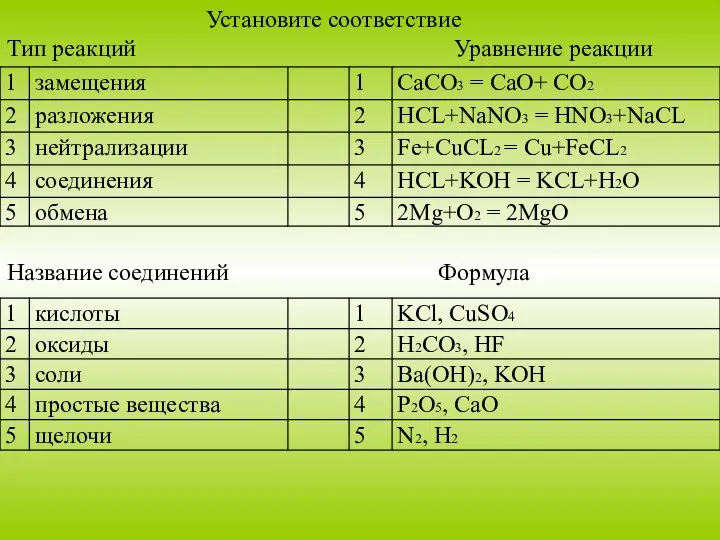
- 13. Установите соответствие Тип реакций Уравнение реакции Название соединений Формула
- 14. Третий лишний" Необходимо найти на каждой строке лишнюю формулу вещества и объяснить, почему именно эта формула
- 16. Скачать презентацию










 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)