Содержание
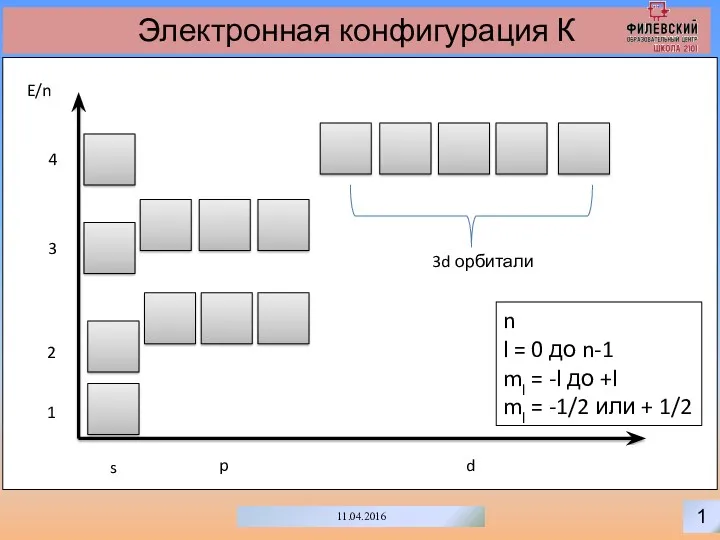
- 2. 1 11.04.2016 Электронная конфигурация К s p d E/n 1 2 3 3d орбитали 4 n
- 3. 2 11.04.2016 Классификация химических элементов Итак, все атомы отличаются по набору квантовых чисел. Но как это
- 4. 3 11.04.2016 Классификация химических элементов Химические элементы неметаллы металлы
- 5. 3 11.04.2016 Классификация химических элементов Химические элементы неметаллы металлы Кислород О2, азот N2, уголь С и
- 6. 3 11.04.2016 Классификация химических элементов Химические элементы неметаллы металлы Кислород О2, азот N2, уголь С и
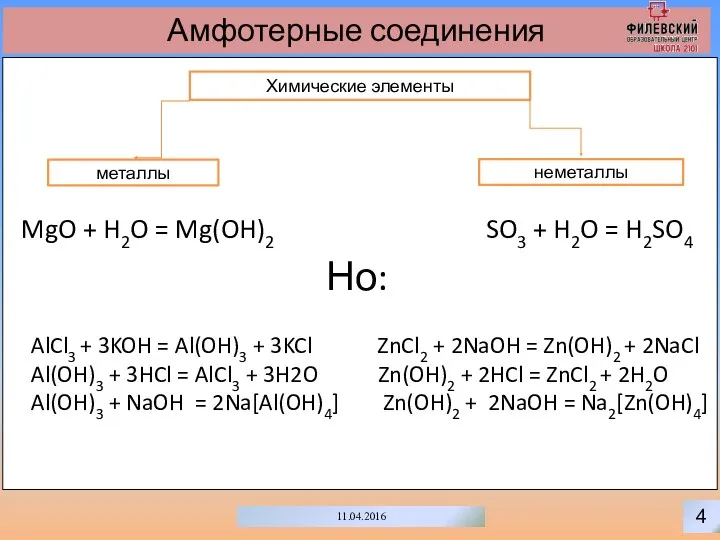
- 7. 4 11.04.2016 Амфотерные соединения Химические элементы неметаллы металлы SO3 + H2O = H2SO4 MgO + H2O
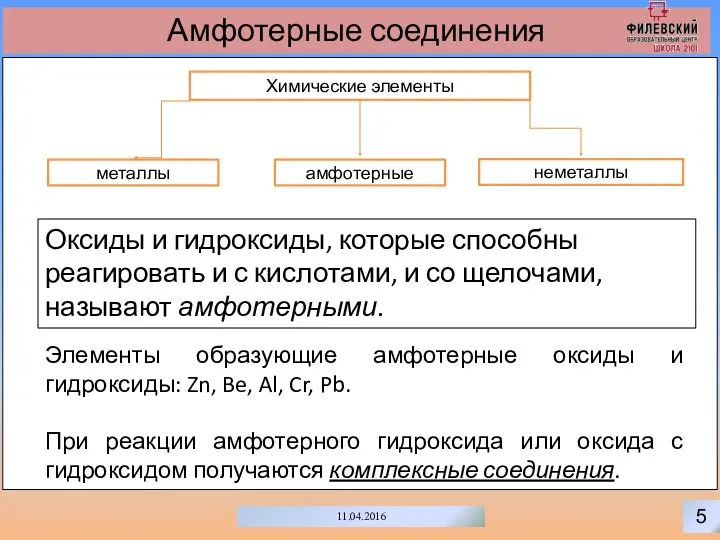
- 8. 5 11.04.2016 Амфотерные соединения Химические элементы неметаллы металлы амфотерные Оксиды и гидроксиды, которые способны реагировать и
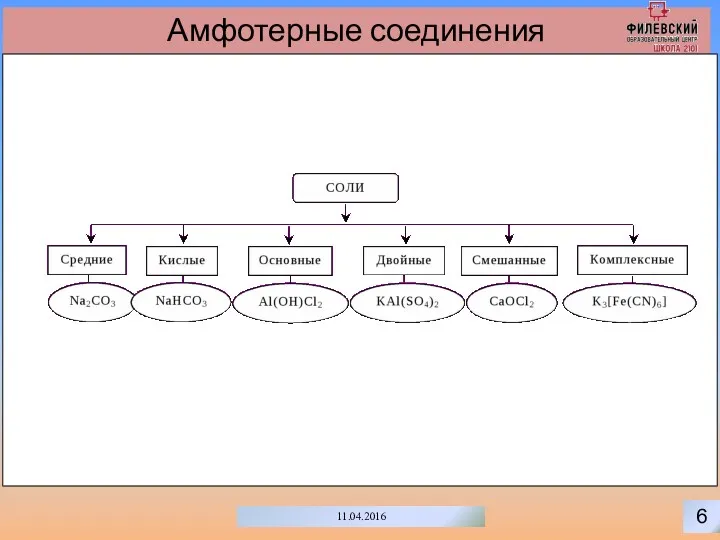
- 9. 6 11.04.2016 Амфотерные соединения
- 10. 7 11.04.2016 Комплексные соединения Комплексные соединения – сложные вещества, в которых можно выделить центральный атом (комплексообразователь)
- 11. 8 11.04.2016 Предыстория До начала XIX века было открыто 33 элемента. К примеру: C, Pb, Au,
- 12. 9 11.04.2016 Предыстория Немецкий химик Иоганн Вольфганг Дёберейнер Дёберейнеру удалось установить первые закономерности в изменении свойств
- 13. 10 11.04.2016 Предыстория Французский геолог и химик Александр Эмиль Бегуйе де Шанкуртуа Шанкуртуа известен тем, что
- 14. 11 11.04.2016 Периодический закон Д.И. Менделеева Li + H2O = Li(OH) Be+ NaOH+H2O = Na2[Be(OH)4] Mg3B2
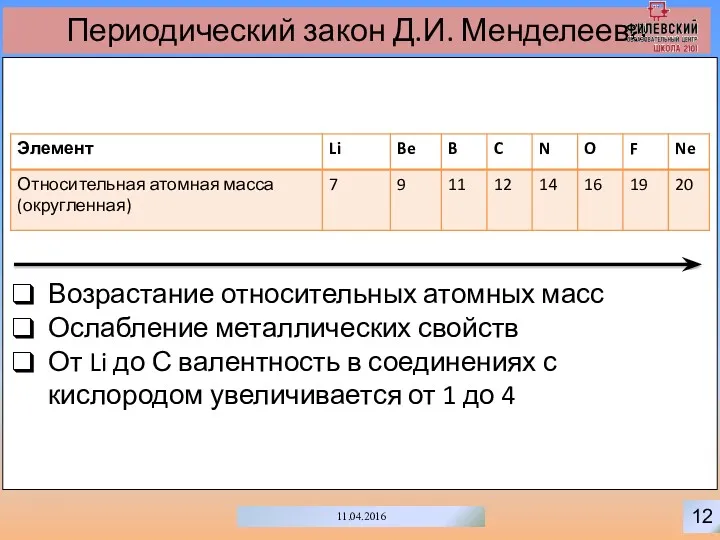
- 15. 12 11.04.2016 Периодический закон Д.И. Менделеева Возрастание относительных атомных масс Ослабление металлических свойств От Li до
- 16. 13 11.04.2016 Периодический закон Д.И. Менделеева Дмитрий Иванович заметил, что наблюдается повторяемость свойств элементов предыдущего ряда
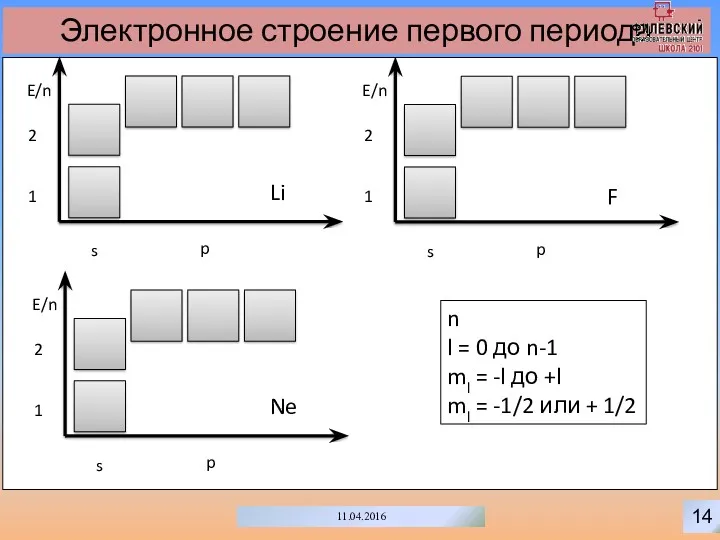
- 17. 14 11.04.2016 Электронное строение первого периода s p E/n 1 2 n l = 0 до
- 18. 15 11.04.2016 Периодический закон Д.И. Менделеева Свойства химических элементов и образуемых ими простых и сложных веществ
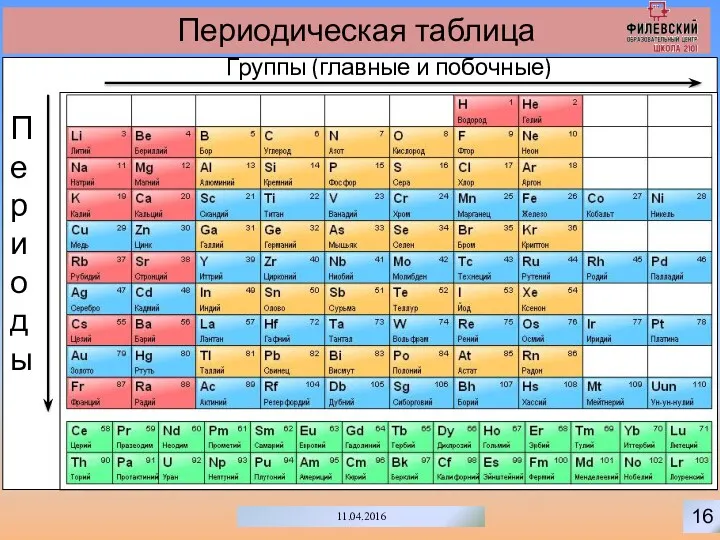
- 19. 16 11.04.2016 Периодическая таблица Группы (главные и побочные) Периоды
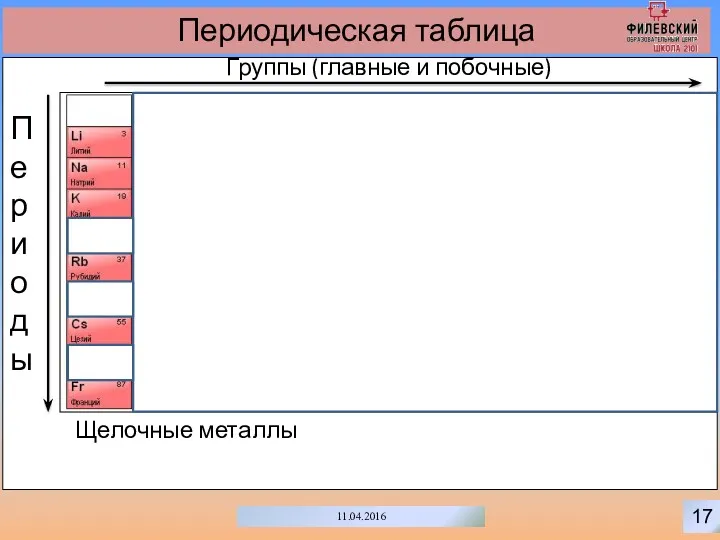
- 20. 17 11.04.2016 Периодическая таблица Группы (главные и побочные) Периоды Щелочные металлы
- 21. 18 11.04.2016 Периодическая таблица Группы (главные и побочные) Периоды Щелочно-земельные металлы
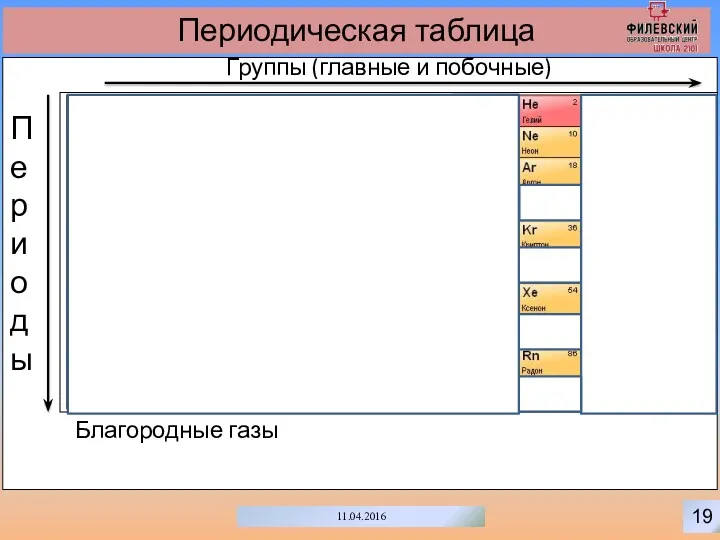
- 22. 19 11.04.2016 Периодическая таблица Группы (главные и побочные) Периоды Благородные газы
- 24. Скачать презентацию











 Влияние состава вещества на эффективность таяния льда и замерзания водных растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных растворов Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Основные понятия и законы химии
Основные понятия и законы химии Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Смоги и их влияние на человека
Смоги и их влияние на человека Изомерия. Виды изомерии
Изомерия. Виды изомерии Углерод
Углерод Спирты. Определение. Классификация
Спирты. Определение. Классификация Гидролиз солей
Гидролиз солей Игра - викторина
Игра - викторина Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Crystal defects
Crystal defects Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Химические свойства металлов
Химические свойства металлов В чём соль соли
В чём соль соли Спирты. Классификация спиртов
Спирты. Классификация спиртов Химические свойства металлов. Коррозия металлов
Химические свойства металлов. Коррозия металлов Химические уравнения
Химические уравнения Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Мытье головы
Мытье головы Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов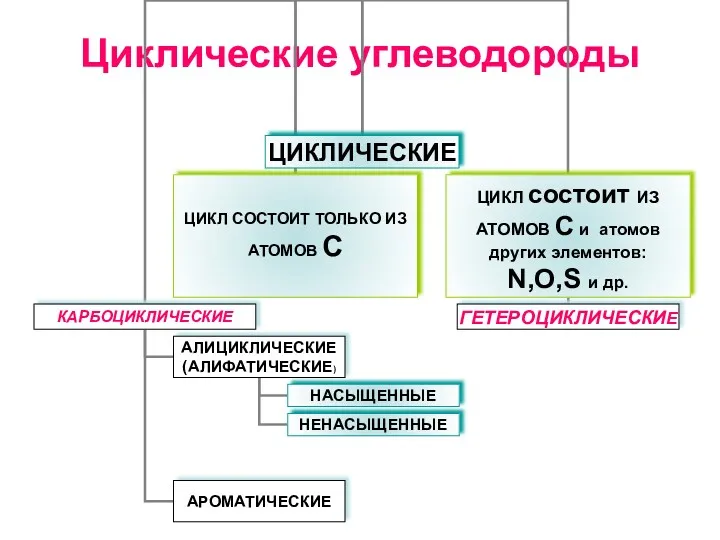 Циклические углеводороды
Циклические углеводороды Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы