Содержание
- 2. Химические свойства металлов обусловлены способностью их атомов легко отдавать электроны с внешнего энергетического уровня, превращаясь в
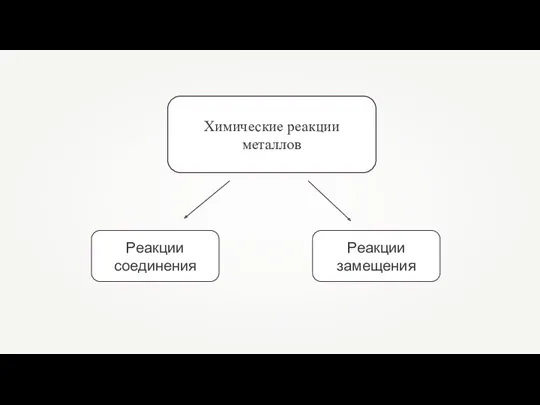
- 3. Химические реакции металлов
- 4. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного из
- 5. Реакции соединения — это такие реакции, в результате которых из одного или нескольких веществ образуется одно
- 6. Me - ne → Me В химических реакциях металлы способны отдавать электроны, т.е. быть восстановителями, проявлять
- 7. Неметаллы Кислоты Вода Соли Металлы Электрохимический ряд активности металлов
- 8. 1.Взаимодействие ме с неме Zn + S = ZnS 4Al + 3О2 = 2Al 2 О3
- 10. Задание: напишите уравнения наблюдаемых реакций S Na+ S= Mg + О2 = Fe+Cl2 = Al+I 2
- 11. 2.Вз.ме с растворами кислот с выделением водорода Электрохимический ряд активности металлов Ме,стоящие до «Н»в ряду активности,
- 12. Взаимодействие ме с кислотами Zn + 2HCl = ZnCl2 + H2↑ H2SO4 + Ca = CaSO4
- 13. Взаимодействие металлов с кислотами Электрохимический ряд активности металлов взаимодействуют с разбавленными кислотами реагируют с концентрированными кислотами
- 14. 3.Вз.ме с растворами солей: Электрохимический ряд активности металлов Начиная с магния, более активный ме вытесняет менее
- 15. Медь (Cu) Взаимодействие меди с нитратом серебра
- 16. 4.Вз. ме с водой с выделением водорода: Электрохимический ряд активности металлов активные металлы 1.С активными ме
- 17. Д.з: 1.Какая из р-й осуществима: Cu + 2Нg(NO3 ) 2 = Zn+Fe (NO3 ) 2 =
- 19. Скачать презентацию















 Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Главная подгруппа IV группы. Общая характеристика элементов
Главная подгруппа IV группы. Общая характеристика элементов Производство азотной кислоты
Производство азотной кислоты Липиды. Классификация
Липиды. Классификация Chimia coordinativă
Chimia coordinativă Химические формулы
Химические формулы Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Химическая связь. Лекция 2-3
Химическая связь. Лекция 2-3 Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Кристаллохимия негіздері
Кристаллохимия негіздері Хімічні формули речовин
Хімічні формули речовин Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Спирты & Фенолы
Спирты & Фенолы Виды вспомогательного оборудования химических производств
Виды вспомогательного оборудования химических производств Стереографическая проекция. Ориентация кристаллов высшей категории
Стереографическая проекция. Ориентация кристаллов высшей категории Методы измерения серы в нефтепродуктах
Методы измерения серы в нефтепродуктах Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Кристаллические решетки
Кристаллические решетки Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Тяжелые металлы. Загрязнение токсичными металлами окружающей среды
Тяжелые металлы. Загрязнение токсичными металлами окружающей среды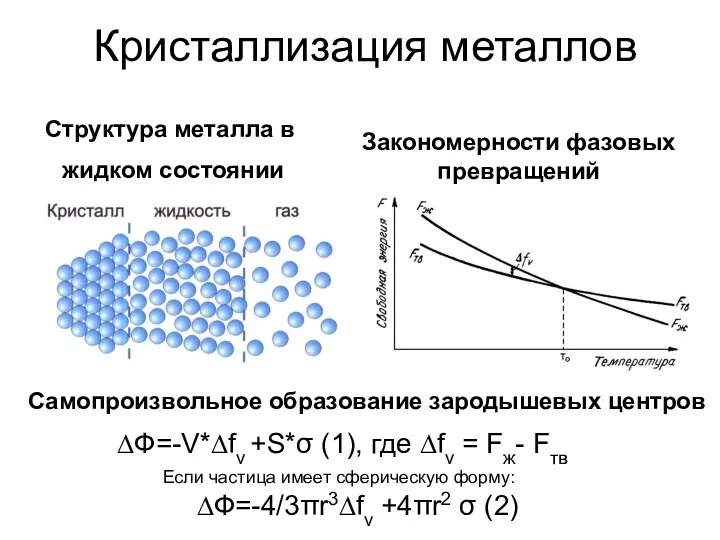 Закономерности фазовых превращений
Закономерности фазовых превращений Химические вещества, как строительные и поделочные материалы
Химические вещества, как строительные и поделочные материалы Хімічні властивості алканів
Хімічні властивості алканів Оксиды. Физические свойства
Оксиды. Физические свойства