Содержание
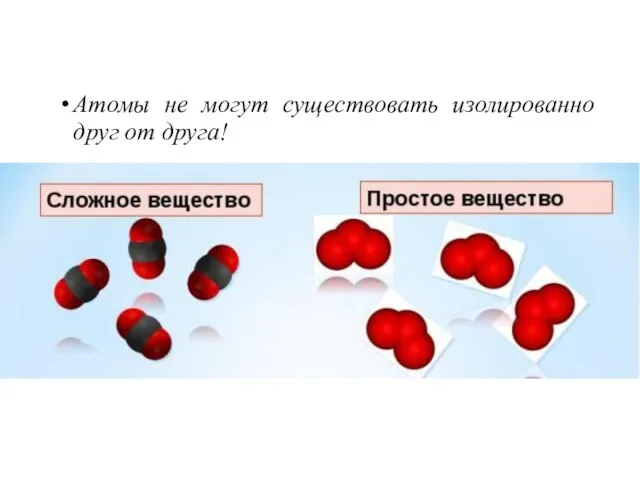
- 2. Атомы не могут существовать изолированно друг от друга!
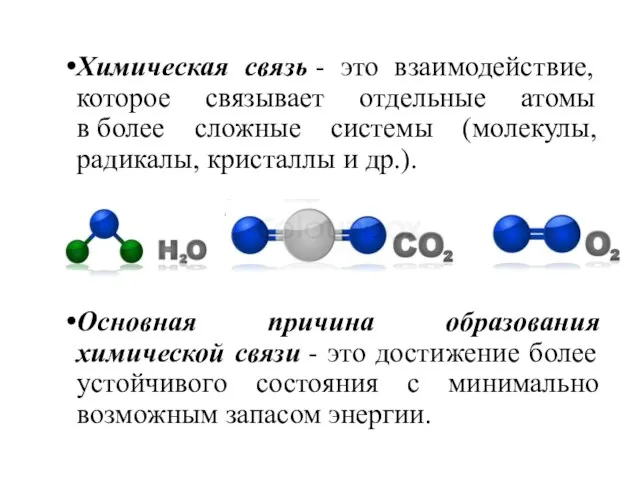
- 3. Основная причина образования химической связи - это достижение более устойчивого состояния с минимально возможным запасом энергии.
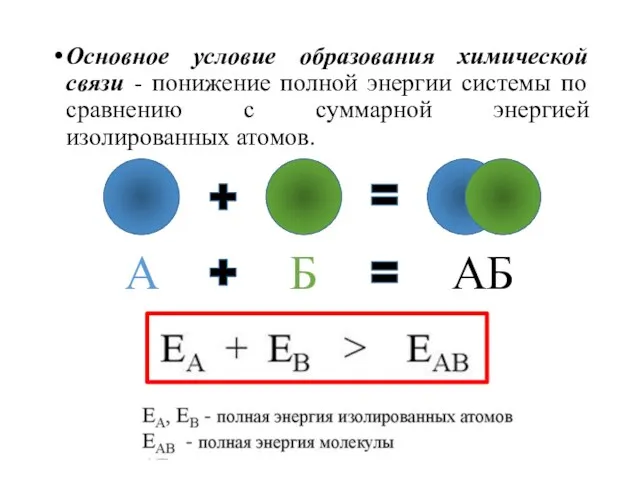
- 4. Основное условие образования химической связи - понижение полной энергии системы по сравнению с суммарной энергией изолированных
- 5. Отличительные признаки химической связи: Понижение энергии системы по сравнению с суммой энергий несвязанных атомов; Перераспределение электронной
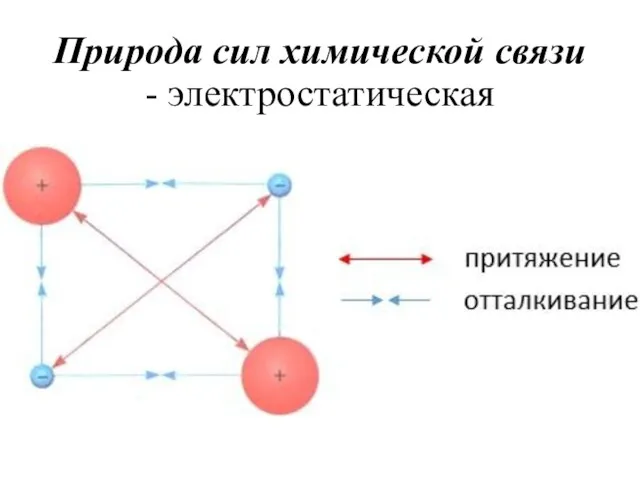
- 6. Природа сил химической связи - электростатическая
- 7. В образовании химической связи принимают участие валентные электроны. При образовании химической связи каждый атом хочет завершить
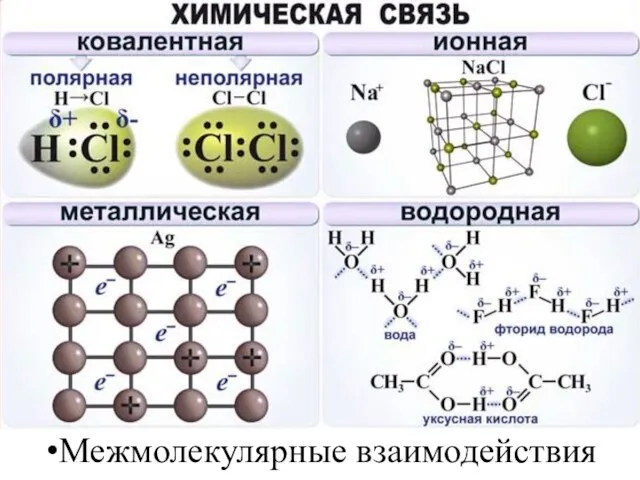
- 8. Межмолекулярные взаимодействия
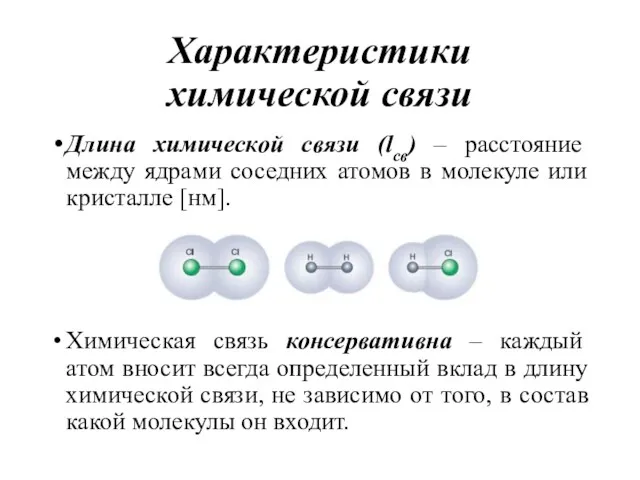
- 9. Характеристики химической связи Длина химической связи (lсв) – расстояние между ядрами соседних атомов в молекуле или
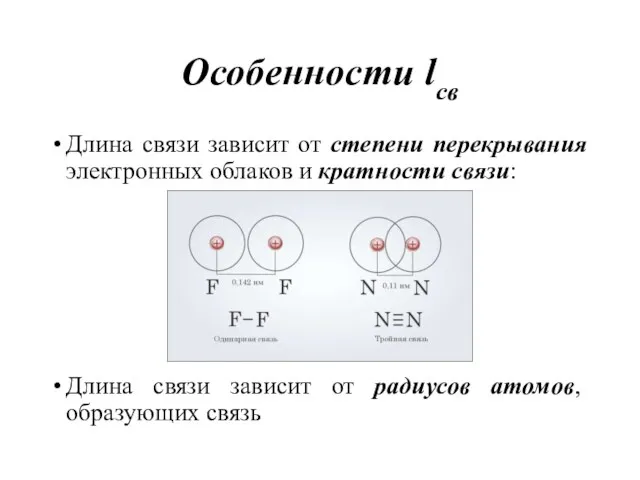
- 10. Особенности lсв Длина связи зависит от степени перекрывания электронных облаков и кратности связи: Длина связи зависит
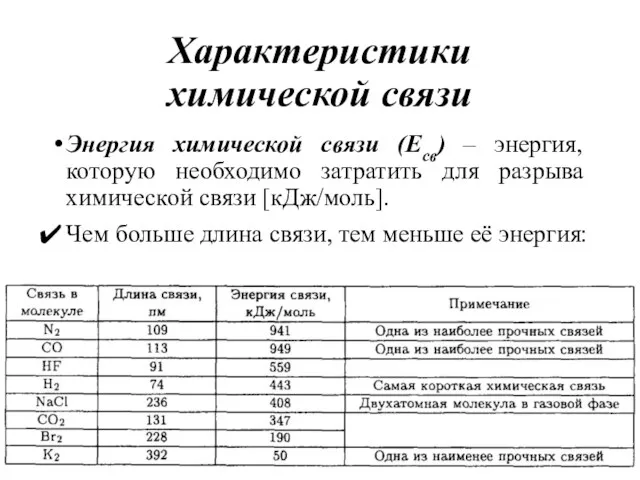
- 11. Характеристики химической связи Энергия химической связи (Есв) – энергия, которую необходимо затратить для разрыва химической связи
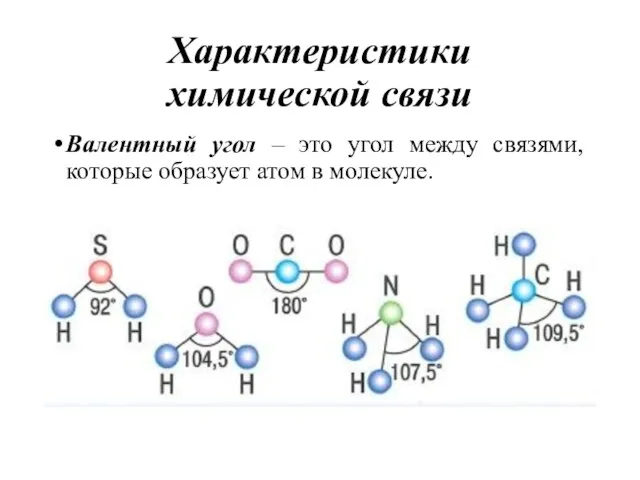
- 12. Характеристики химической связи Валентный угол – это угол между связями, которые образует атом в молекуле.
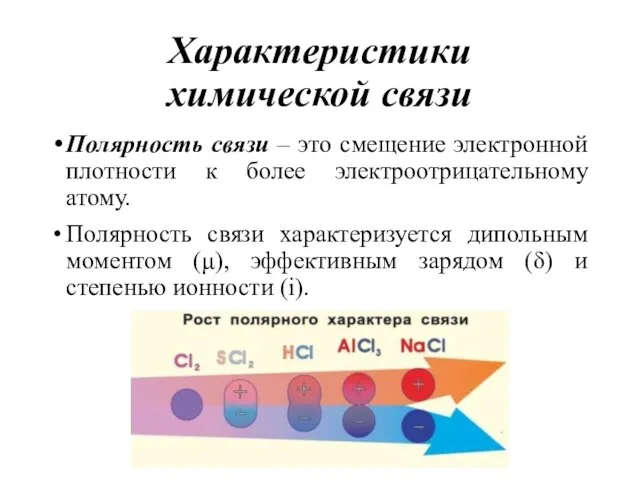
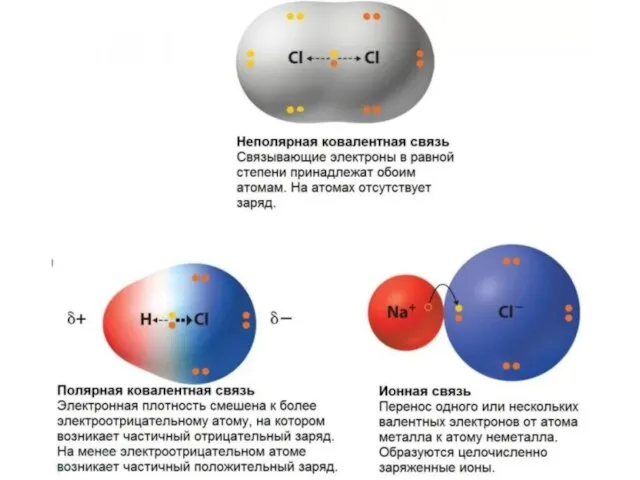
- 13. Характеристики химической связи Полярность связи – это смещение электронной плотности к более электроотрицательному атому. Полярность связи
- 14. Дипольный момент [Кл·м] = [D] ℓ – длина диполя; q – абсолютная величина заряда в кулонах
- 15. Эффективный заряд – безразмерная величина, определяемая отношением экспериментально найденного μ к теоретически рассчитанному. Степень ионности –
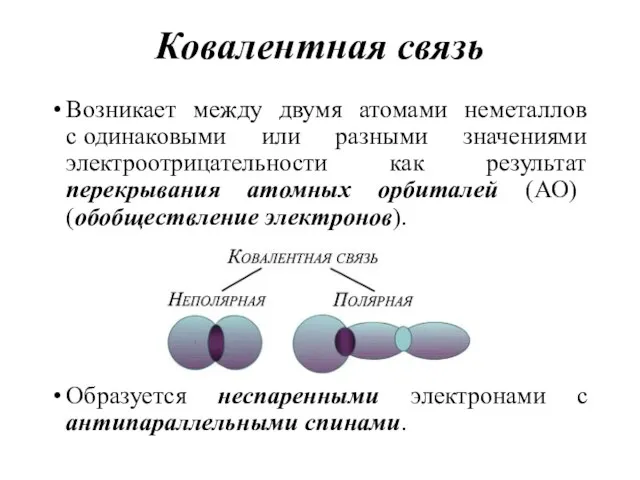
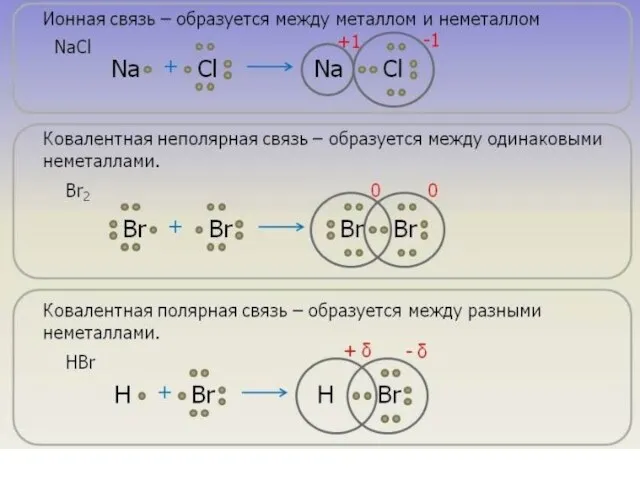
- 16. Ковалентная связь Возникает между двумя атомами неметаллов с одинаковыми или разными значениями электроотрицательности как результат перекрывания
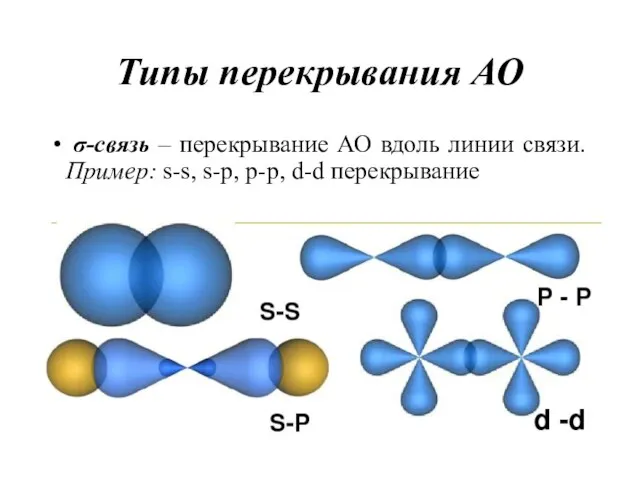
- 17. Типы перекрывания АО σ-связь – перекрывание АО вдоль линии связи. Пример: s-s, s-p, p-p, d-d перекрывание
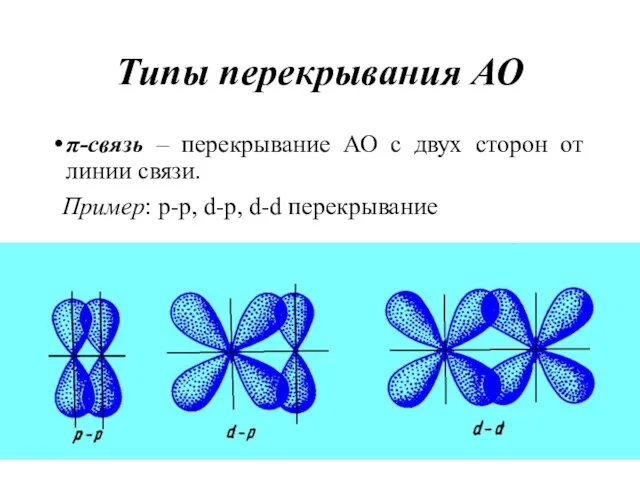
- 18. Типы перекрывания АО π-связь – перекрывание АО с двух сторон от линии связи. Пример: p-p, d-p,
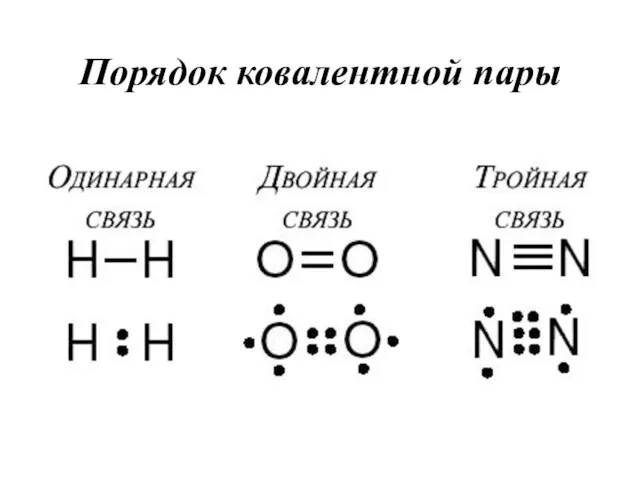
- 19. Кратность связи Это число общих электронных пар (количество связей) между взаимодействующими атомами
- 20. Механизмы образования ковалентной связи Обменный Донорно-акцепторный Дативный
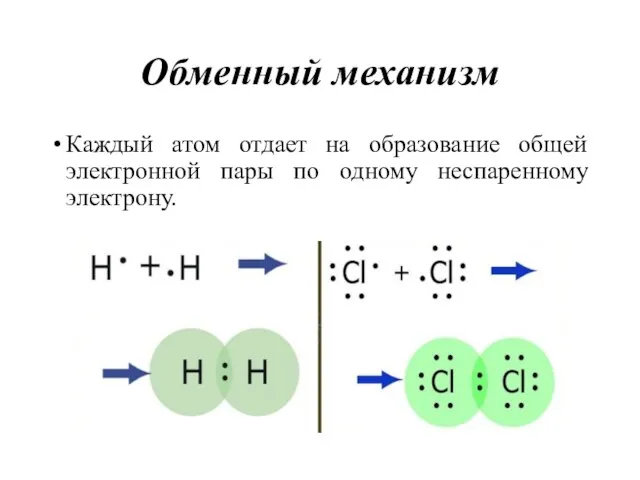
- 21. Обменный механизм Каждый атом отдает на образование общей электронной пары по одному неспаренному электрону.
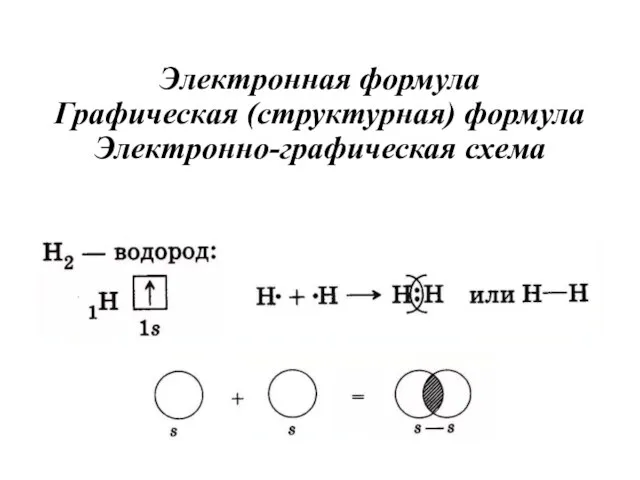
- 22. Электронная формула Графическая (структурная) формула Электронно-графическая схема
- 23. Порядок ковалентной пары
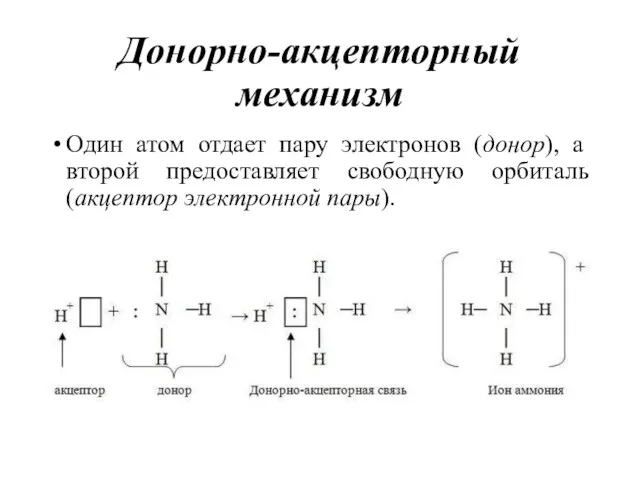
- 24. Донорно-акцепторный механизм Один атом отдает пару электронов (донор), а второй предоставляет свободную орбиталь (акцептор электронной пары).
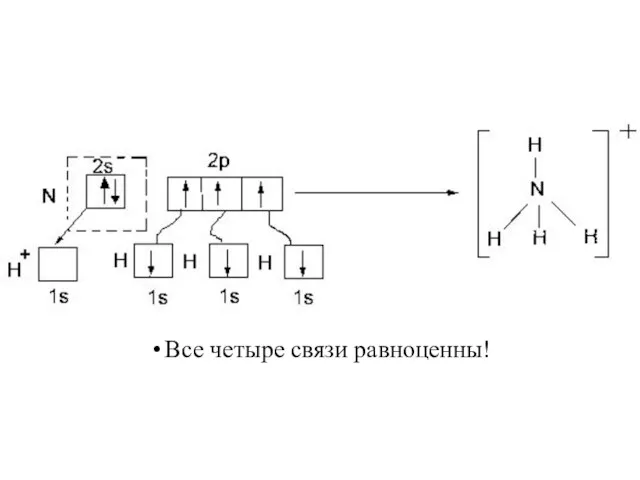
- 25. Все четыре связи равноценны!
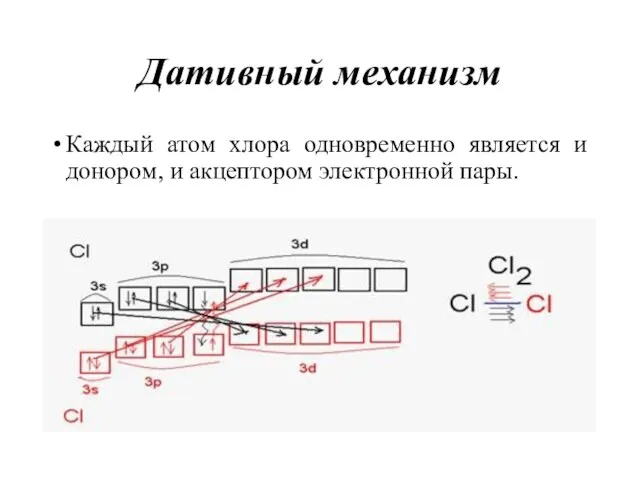
- 26. Дативный механизм Каждый атом хлора одновременно является и донором, и акцептором электронной пары.
- 27. Свойства ковалентной связи Полярность – смещение электронной плотности к более электроотрицательному атому. Ковалентная неполярная связь –
- 29. Свойства ковалентной связи Насыщаемость – определенное число химических связей атома, вызванное ограниченным числом валентных связей и
- 30. Свойства ковалентной связи Направленность – молекулы и ионы с ковалентными связями имеют определённое геометрическое строение. Геометрическое
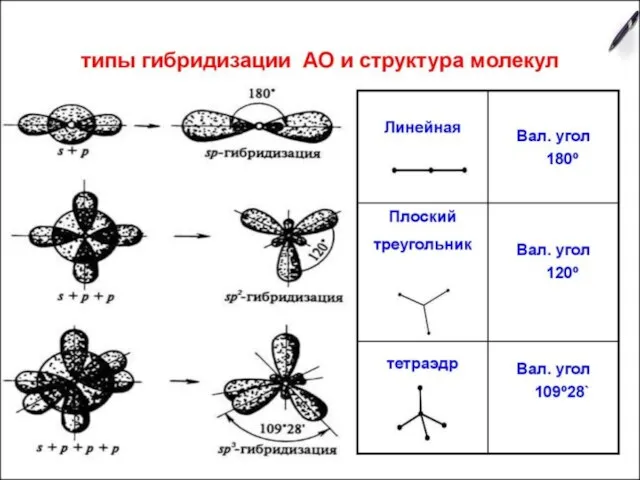
- 31. Теория гибридизации Гибридизация – это выравнивание атомных орбиталей по форме и энергии. Основные положения теории гибридизации:
- 32. Алгоритм определения типа гибридизации в молекулах Записать электронно-графическую формулу для валентных электронов (участвуют в образовании химической
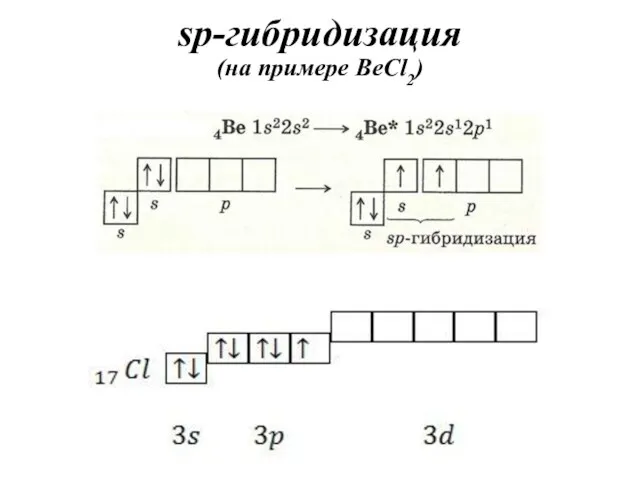
- 33. sp-гибридизация (на примере BeCl2)
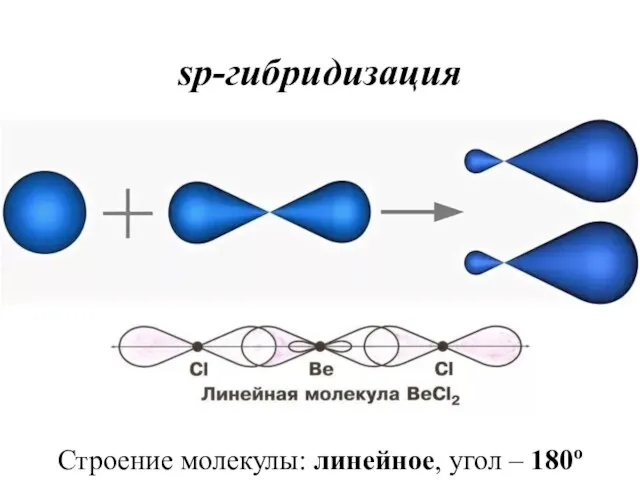
- 34. sp-гибридизация Строение молекулы: линейное, угол – 180о
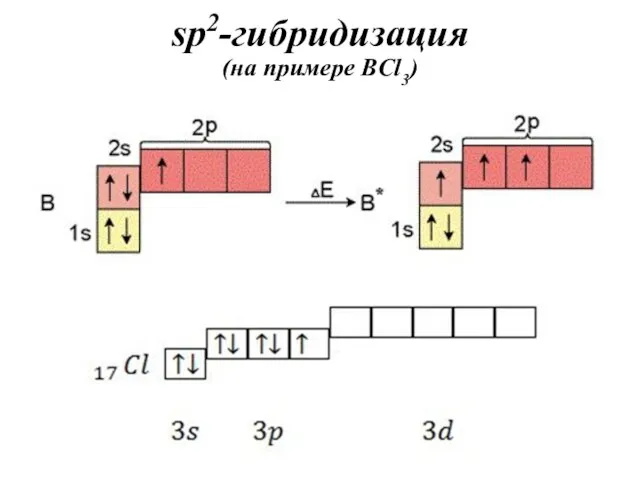
- 35. sp2-гибридизация (на примере BCl3)
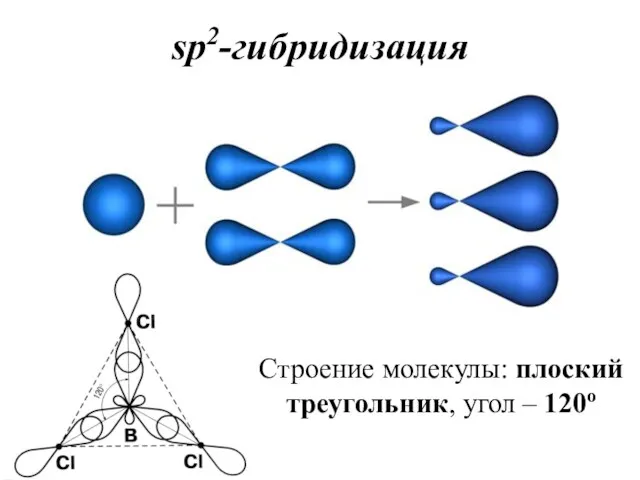
- 36. sp2-гибридизация Строение молекулы: плоский треугольник, угол – 120о
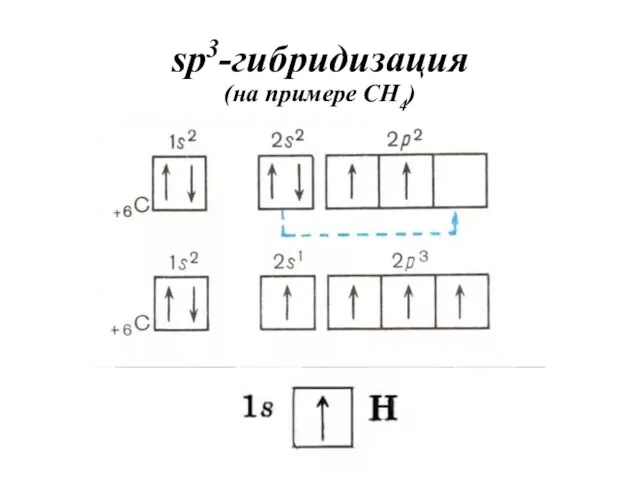
- 37. sp3-гибридизация (на примере CH4)
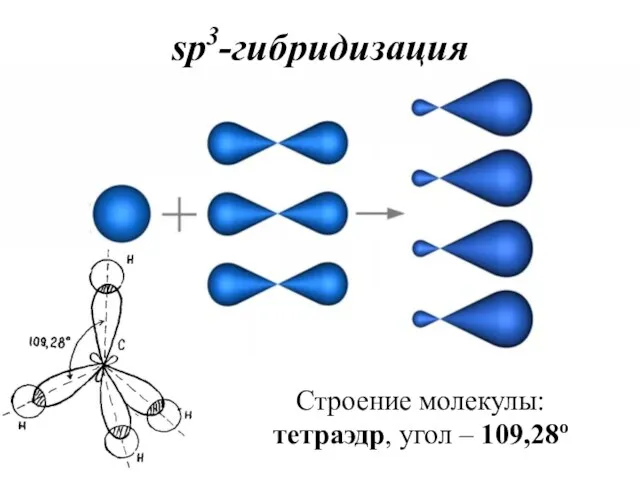
- 38. sp3-гибридизация Строение молекулы: тетраэдр, угол – 109,28о
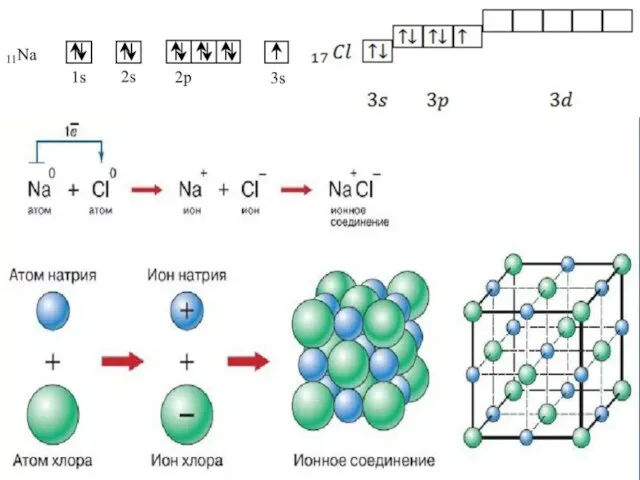
- 40. Ионная связь Осуществляется за счет электростатического взаимодействия противоположно заряженных ионов в химическом соединении. Возникает между катионами
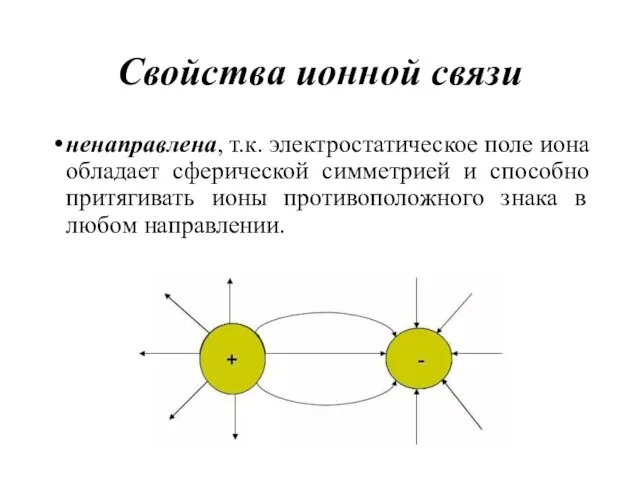
- 42. Свойства ионной связи ненаправлена, т.к. электростатическое поле иона обладает сферической симметрией и способно притягивать ионы противоположного
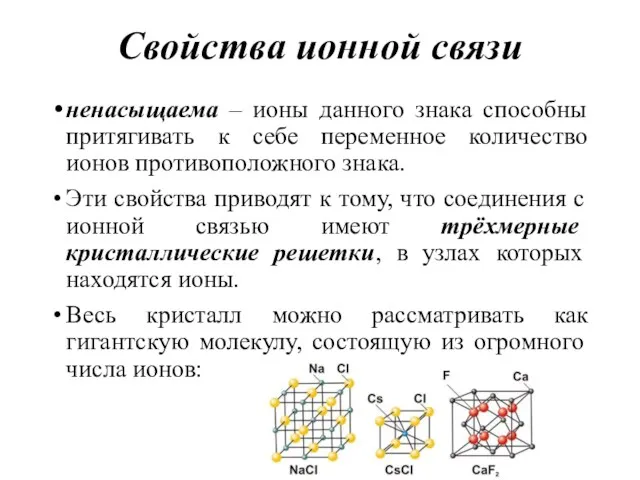
- 43. Свойства ионной связи ненасыщаема – ионы данного знака способны притягивать к себе переменное количество ионов противоположного
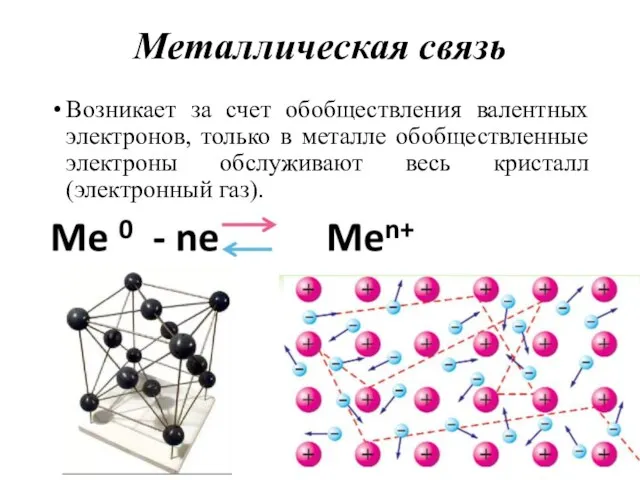
- 45. Металлическая связь Возникает за счет обобществления валентных электронов, только в металле обобществленные электроны обслуживают весь кристалл
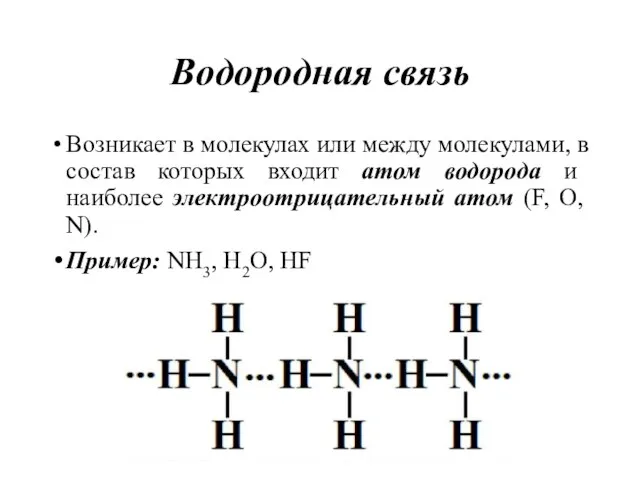
- 46. Водородная связь Возникает в молекулах или между молекулами, в состав которых входит атом водорода и наиболее
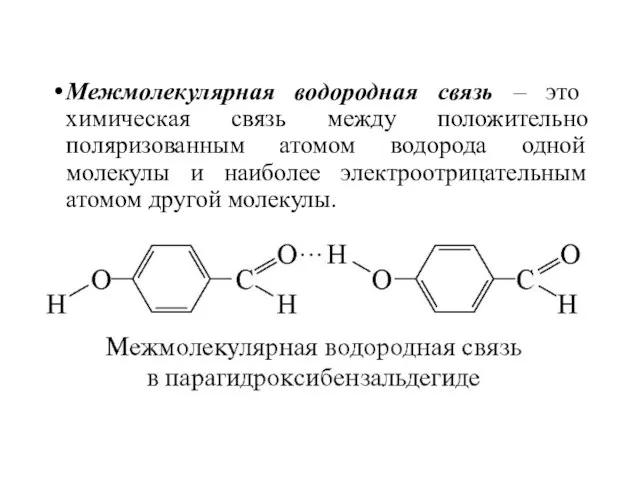
- 47. Межмолекулярная водородная связь – это химическая связь между положительно поляризованным атомом водорода одной молекулы и наиболее
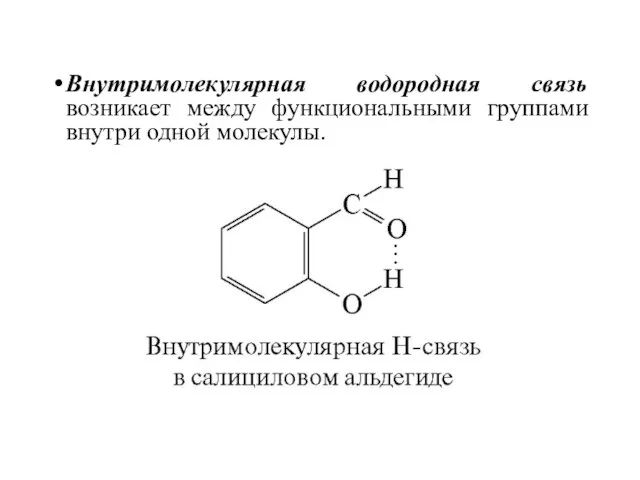
- 48. Внутримолекулярная водородная связь возникает между функциональными группами внутри одной молекулы.
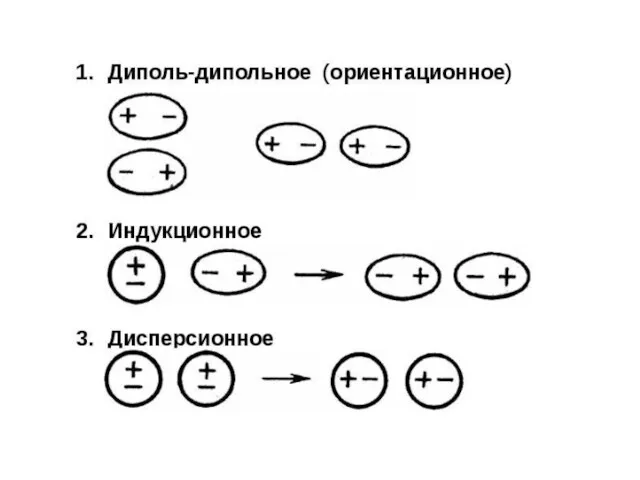
- 49. Силы Ван-дер-Ваальса Связи между молекулами, обусловленные электростатическим взаимодействием. Различают 3 типа сил: Ориентационное (диполь-дипольное) взаимодействие возникает
- 54. Скачать презентацию


![Дипольный момент [Кл·м] = [D] ℓ – длина диполя; q – абсолютная величина заряда в кулонах](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/424894/slide-13.jpg)










 Химическая термодинамика. Задачи
Химическая термодинамика. Задачи Циклоалканы
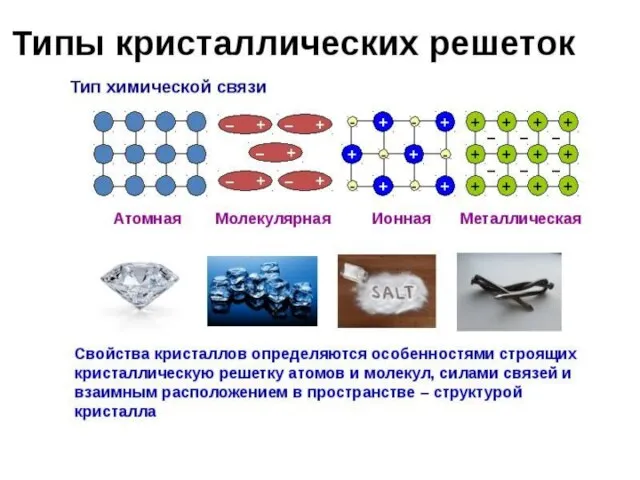
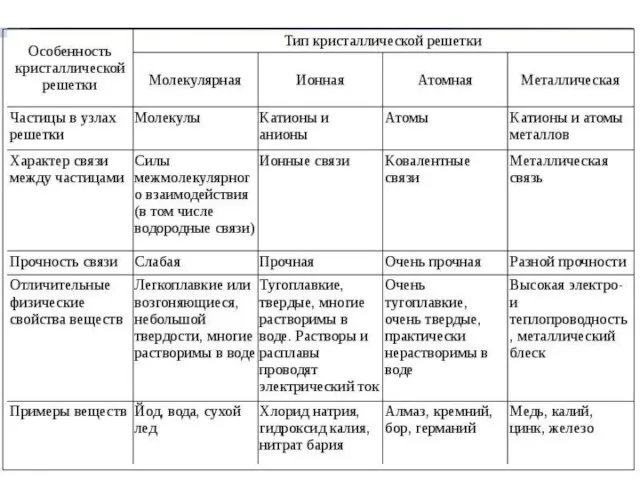
Циклоалканы Откуда берутся кристаллы
Откуда берутся кристаллы Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3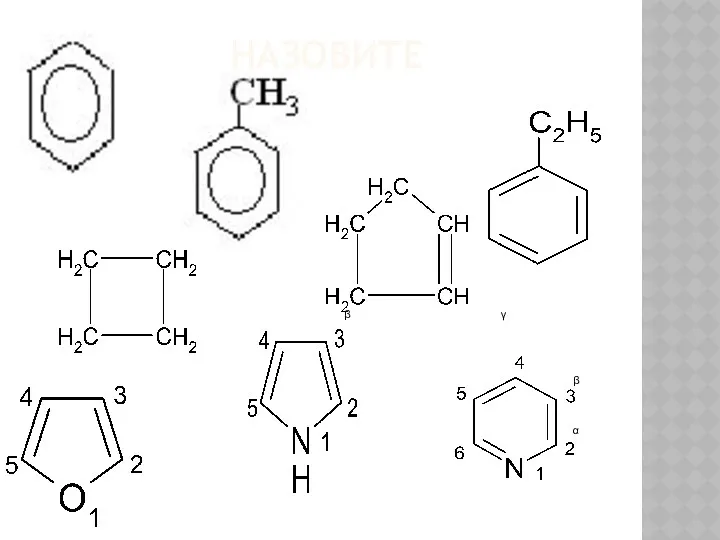 Общие сведения о гетероциклах
Общие сведения о гетероциклах Железо, медь
Железо, медь Стан електронів у атомі
Стан електронів у атомі Классификация химических реакций
Классификация химических реакций Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Синтетические волокна
Синтетические волокна Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Геохимия рудных месторождений
Геохимия рудных месторождений Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода Своя игра Знаешь ли ты химические элементы?
Своя игра Знаешь ли ты химические элементы? Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Химические уравнения. Закон сохранения массы веществ
Химические уравнения. Закон сохранения массы веществ Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических Интересные факты о химических веществах
Интересные факты о химических веществах Технология монокристаллов и особо чистых веществ
Технология монокристаллов и особо чистых веществ Уравнение Г-Х-К для мембранного потенциала
Уравнение Г-Х-К для мембранного потенциала ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Минералы и горные породы
Минералы и горные породы Попутные нефтяные газы
Попутные нефтяные газы Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Жиры (триглицериды)
Жиры (триглицериды) Предмет органической химии
Предмет органической химии