Слайд 2
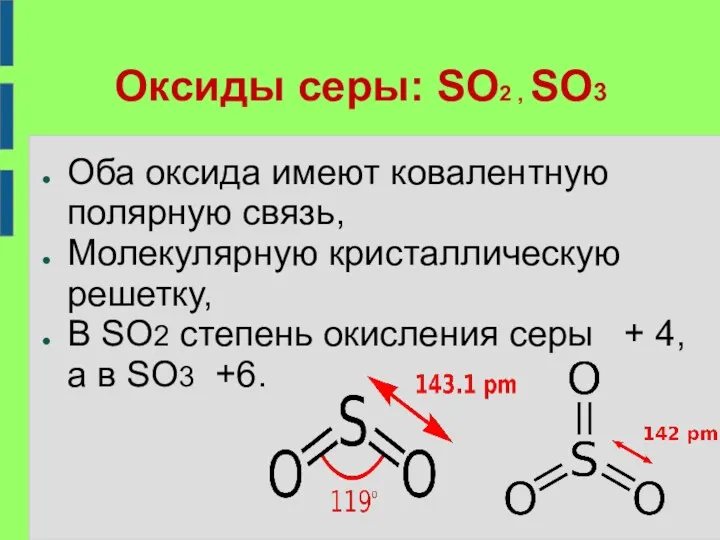
Оксиды серы: SO2 , SO3
Оба оксида имеют ковалентную полярную связь,
Молекулярную кристаллическую
решетку,
В SO2 степень окисления серы + 4, а в SO3 +6.
Слайд 3

Физические свойства SO2
Оксид серы (IV), диоксид серы, сернистый газ – это
….
Бесцветный газ с характерным резким запахом (запах загорающейся спички);
Растворяется в воде с образованием нестойкой се́рнистой кислоты (H2SO3);
SO2 очень токсичен!
Слайд 4

Физические свойства SO3
Оксид серы (VI), триоксид серы – это …
Легколетучая бесцветная
маслянистая жидкость с удушающим запахом;
При температурах ниже 16,9 °C застывает и образует смеси различных кристаллических модификаций;
В природе не встречается;
Ядовит!
Слайд 5

Способы получения SO2
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2+11O2→2Fe2O3++8SO2
Слайд 6

В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3
сразу разлагается на SO2 и H2O:
Na2SO3+H2SO4→Na2SO4+H2SO3
H2SO3→H2O+SO2
Слайд 7

Способы получения SO3
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора V2O5, реакция
обратимая.
2SO2+O2 → 2SO3
Слайд 8
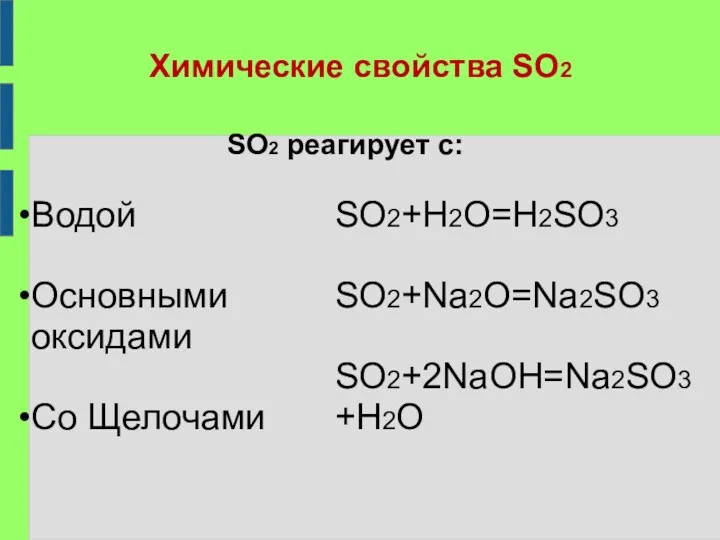
Химические свойства SO2
SO2 реагирует с:
Водой
Основными оксидами
Co Щелочами
SO2+H2O=H2SO3
SO2+Na2O=Na2SO3
SO2+2NaOH=Na2SO3+H2O
Слайд 9

Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные
свойства
SO2 + 2HNO3 →
H2SO4+ 2NO2
SO2+Cl2 = SO2Cl2
дихлорид-диоксид серы
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства
SO2 + 2H2S→2H2O + 3S
Слайд 10

Химические свойства SO3
Основными оксидами SO3+Na2O = Na2SO4
Водой SO3+H2O=H2SO4
Основаниями 2KOH+SO3→K2SO4+H2O
SO3 растворяется
в серной кислоте, образуя олеум:
H2SO4+SO3→H2S2O7 (олеум)
Слайд 11

Применение SO2
Для производства сернистой кислоты;
В качестве консерванта (пищевая добавка E220)
в вине;
Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады;
Для отбеливания соломы, шелка и шерсти.
Слайд 12

Применение SO3
Для получения серной кислоты
Слайд 13

Кислородсодержащие кислоты и соли серы
H2SO3 – сернистая кислота (неустойчивая)
H2SO4
- серная кислота
CuSO4*5H2O - медный купорос
FeSO4*7H2O - железный купорос
СaSO4*2H2O - гипс
Слайд 14

Физические свойства H2SO4
- тяжелая маслянистая жидкость ("купоросное масло"),
- хорошо
растворима в воде – с сильным нагревом,
- обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара),
- концентрированная 98% H2SO4 – сильный окислитель
Слайд 15

Химические свойства H2SO4
Изменяет окраску индикаторов:
- лакмус (красный)
- метилоранж (красный)
- фенолфталеин (б/ц)
Реагирует с основными и амфотерными оксидами
CuO + H2SO4 = CuSO4 + H2O
Al2O3 +3H2SO4 = Al2(SO4)3 +3Н2О
Регагирует с основаниями
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Слайд 16

Реагирует с солями, если образуется осадок, газ или вода:
СаСО3 +
H2SO4 = СаSO4 + CO2 (газ) + H2O
BaCl2 + H2SO4 = BaSO4 (белый осадок) + 2HCl (качественная реакция на серную кислоту).
Слайд 17

Взаимодействие с металлами:
а) с щелочными и щелочноземельными металлами (активные Ме)
8Na
+5 H2SO4(конц.) → 4Na2SO4 + H2S + 4H2O
Na + H2SO4(разб.) → Na2SO4 + H2
б) с металлами до водорода (Ме средней активности)
Zn + H2SO4(разб.) → ZnSO4 + H2
Zn + 2H2SO4(конц.) = SO2 + H2O + ZnSO4
Al, Fe, Cr + конц.серная к-та → без нагревания пассивируются, т.е. не взаимодействуют
Слайд 18

в) с металлами после водорода (малоактивные Ме)
Разбавленная серная кислота не реагирует
с металлами после водорода!
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
Pt и Au не реагируют с H2SO4(конц)!!!
Слайд 19
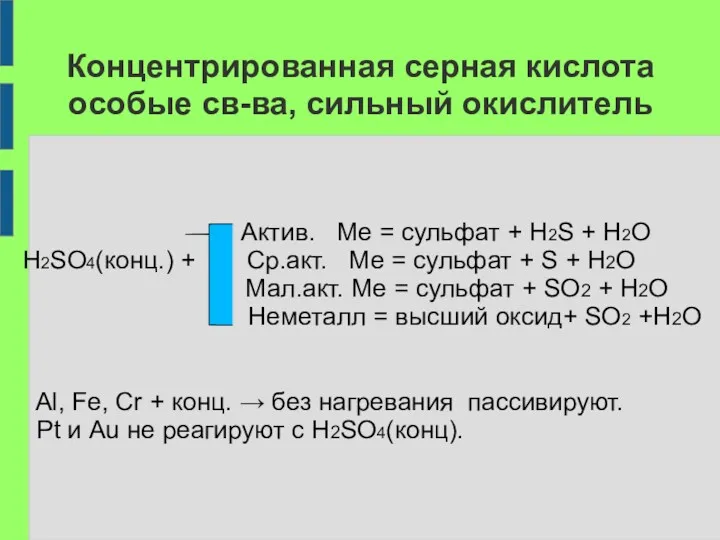
Концентрированная серная кислота
особые св-ва, сильный окислитель
Актив. Ме = сульфат +
H2S + H2O
H2SO4(конц.) + Ср.акт. Ме = сульфат + S + H2O
Мал.акт. Ме = сульфат + SO2 + H2O
Неметалл = высший оксид+ SO2 +H2O
Al, Fe, Cr + конц. → без нагревания пассивируют.
Pt и Au не реагируют с H2SO4(конц).
Слайд 20

С неметаллами
2P + 5H2SO4(конц.) → 5SO2 + 2H3PO4 + 2Н2О
С + 2H2SO4(конц.) → CO2 + 2SO2 + 2H2O
S + 2H2SO4(конц.) → 3SO2 + 2H2O



















 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды