Содержание
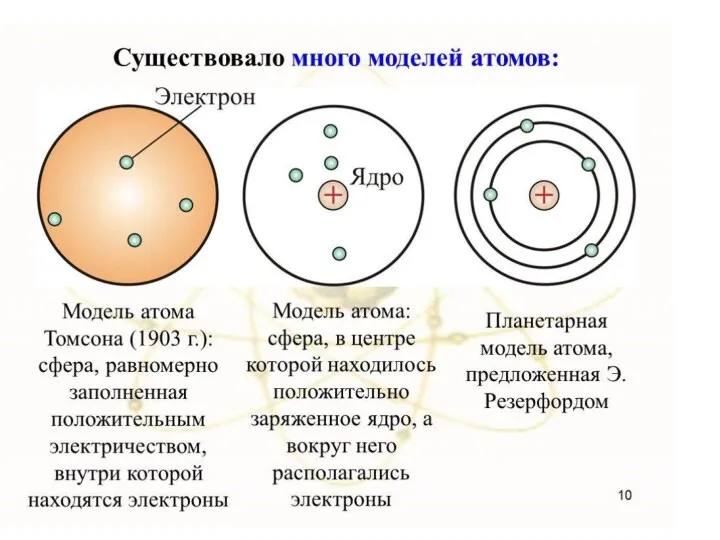
- 5. Атом - устойчивая система, образованная элементарными частицами противоположного заряда. Основная его масса сосредоточена в ядре. Ядро
- 6. В околоядерном пространстве находятся электроны. Электрон - это отрицательно заряженная элементарная частица (заряд = -1) Масса
- 7. Свет представляет собой поток материальных частиц, получивших название квантов света или фотонов. Представление о квантах впервые
- 8. Так как электрон обладает волновыми свойствами, его движение можно описать волновым уравнением, подобно тому как описывают
- 9. Часть внутриатомного пространства, в котором движется электрон, называют электронным облаком. Его плотность в различных точках определяется
- 11. 1. Главное квантовое число n. С точки зрения планетарной модели Бора-Резерфорда n характеризует энергию электрона, находящегося
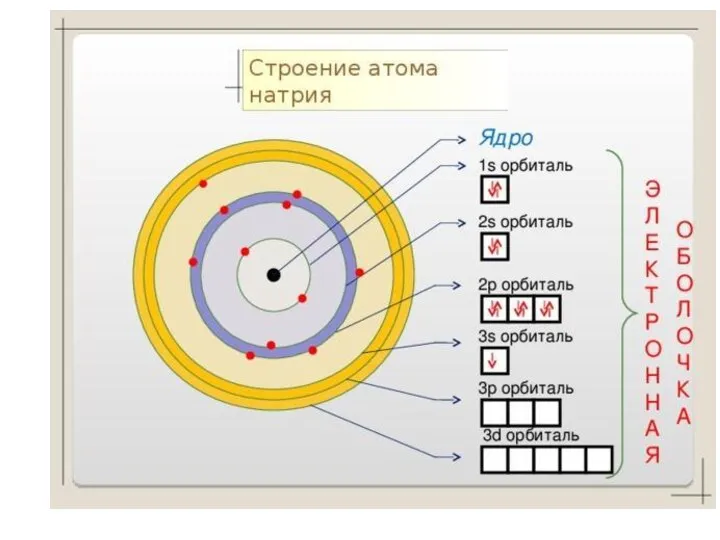
- 12. Главное квантовое число определяет энергию орбитали и степень ее удаленности от ядра. Если рассматривать строение атома
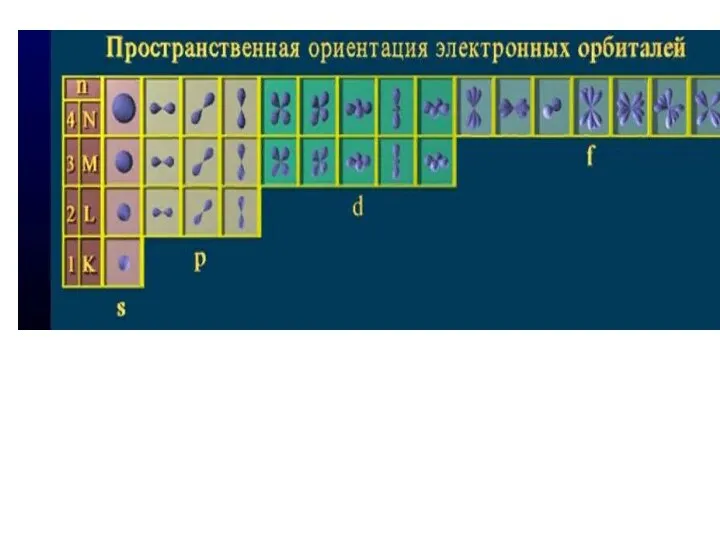
- 13. 2. Орбитальное квантовое число l – характеризует форму орбитали - области пространства, где наиболее вероятно пребывание
- 14. 3. Магнитное квантовое число ml – характеризует ориентацию орбитали l в пространстве. По формуле ml =
- 15. Значения магнитного квантового числа для этих трех типов орбиталей варьируются от -1 до +1 с переходом
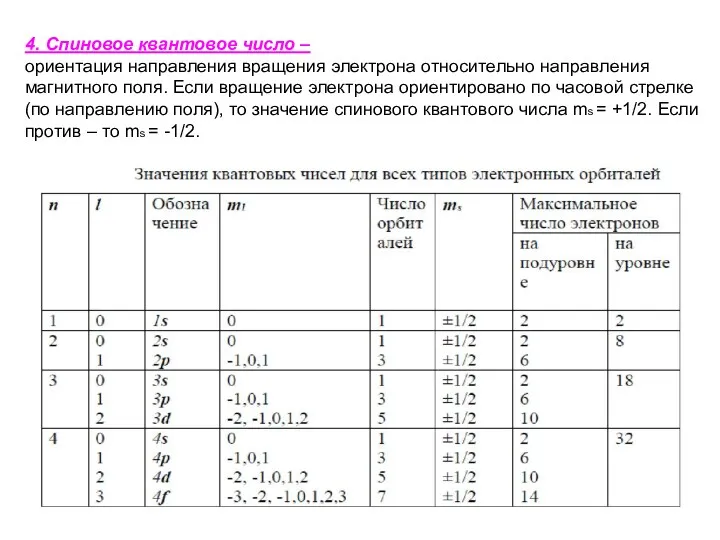
- 17. 4. Спиновое квантовое число – ориентация направления вращения электрона относительно направления магнитного поля. Если вращение электрона
- 18. ПРИНЦИПЫ ЗАПОЛНЕНИЯ ЭЛЕКТРОННЫХ ОБОЛОЧЕК. -Заряд одного электрона численно равен заряду одного протона. -Протоны сосредоточены в ядре
- 19. 1. Принцип наименьшей энергии Последовательность размещения электронов по орбиталям должна соответствовать наименьшей энергии атома в целом.
- 20. 2. Принцип Паули. В атоме не может быть двух электронов, для которых одинаковы значения всех четырех
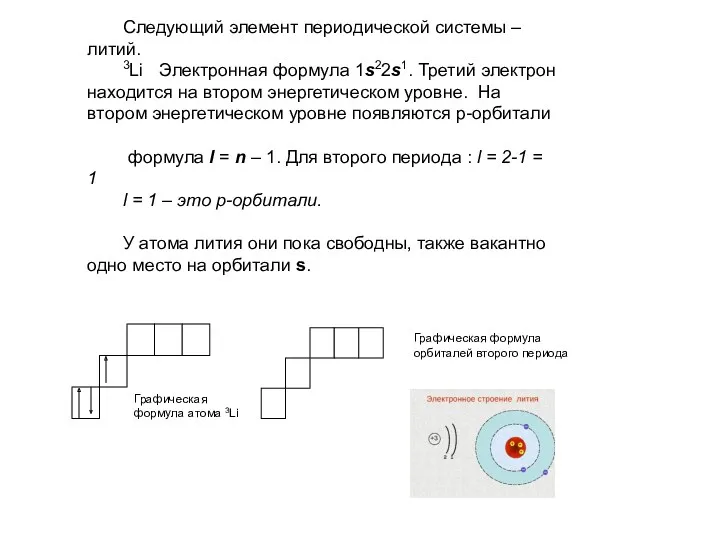
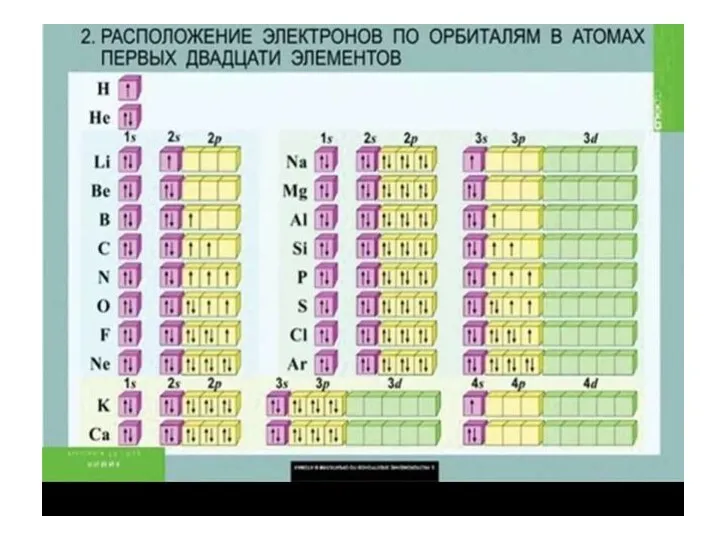
- 21. Следующий элемент периодической системы – литий. 3Li Электронная формула 1s22s1. Третий электрон находится на втором энергетическом
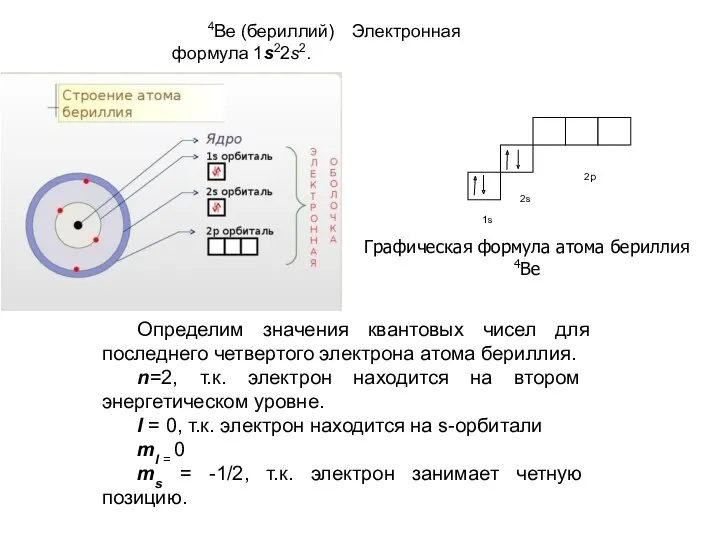
- 22. 4Be (бериллий) Электронная формула 1s22s2. Определим значения квантовых чисел для последнего четвертого электрона атома бериллия. n=2,
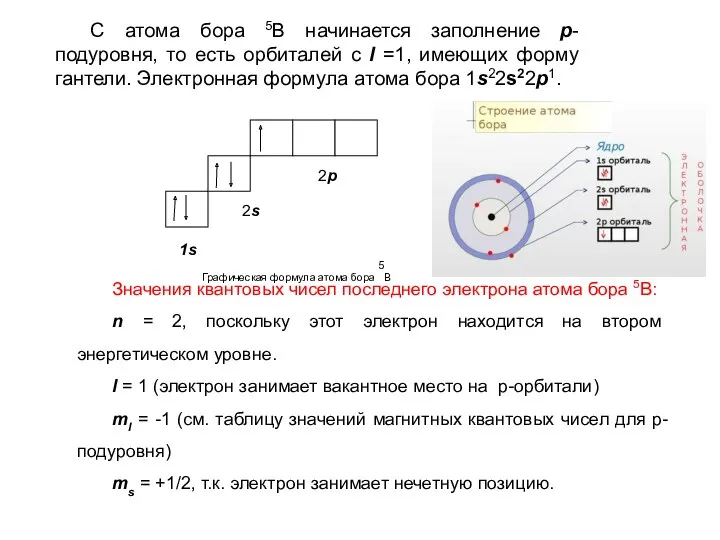
- 23. С атома бора 5B начинается заполнение р-подуровня, то есть орбиталей с l =1, имеющих форму гантели.
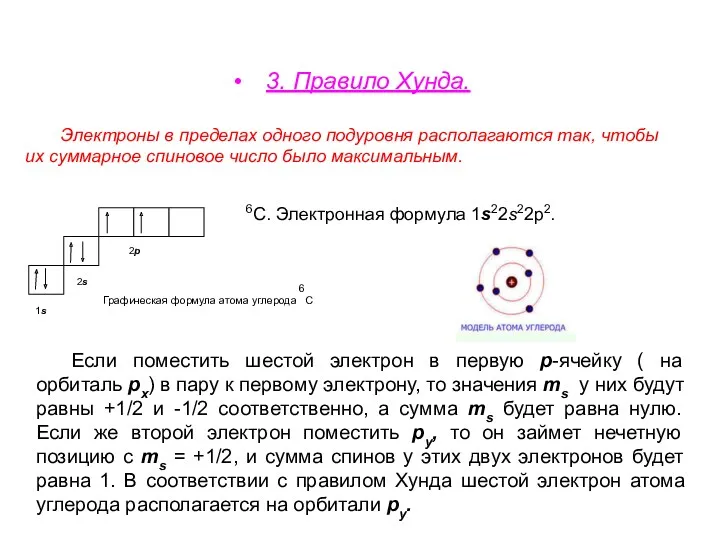
- 24. 3. Правило Хунда. Электроны в пределах одного подуровня располагаются так, чтобы их суммарное спиновое число было
- 25. Атом кислорода 8О. Нечетные позиции р-подуровня уже заняты, но свободными остаются четные позиции. Электронная формула атома
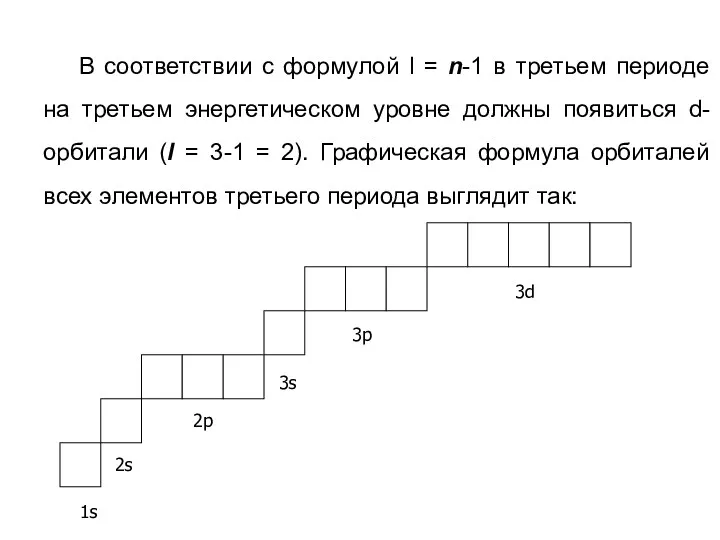
- 26. В соответствии с формулой l = n-1 в третьем периоде на третьем энергетическом уровне должны появиться
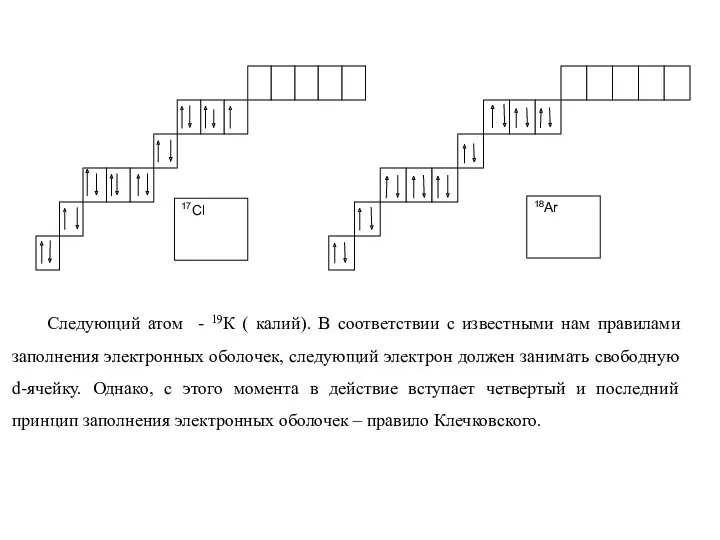
- 28. Следующий атом - 19К ( калий). В соответствии с известными нам правилами заполнения электронных оболочек, следующий
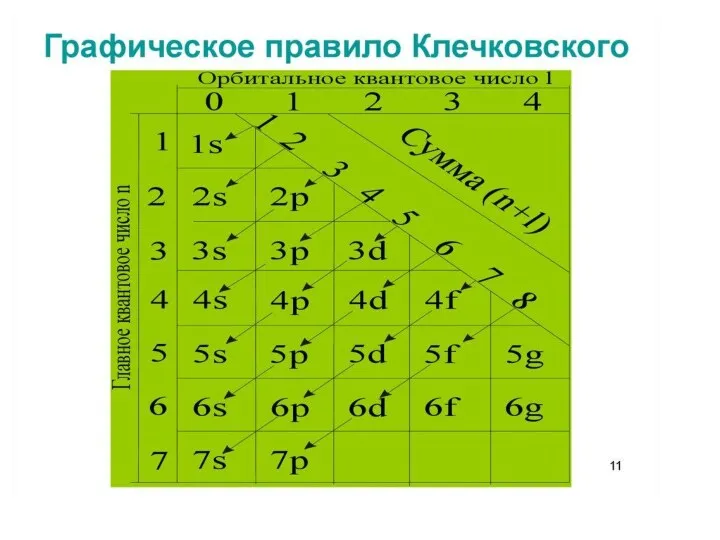
- 30. 4. Правило Клечковского Если атом находится в основном состоянии, то при заполнении свободных орбиталей электрон занимает
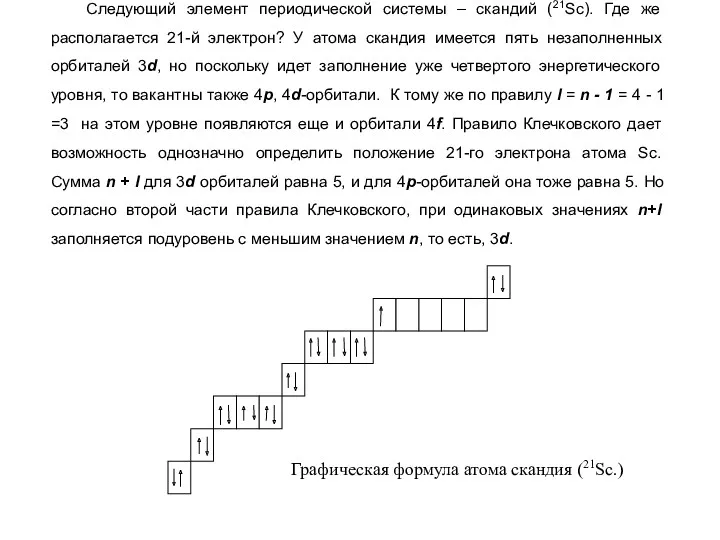
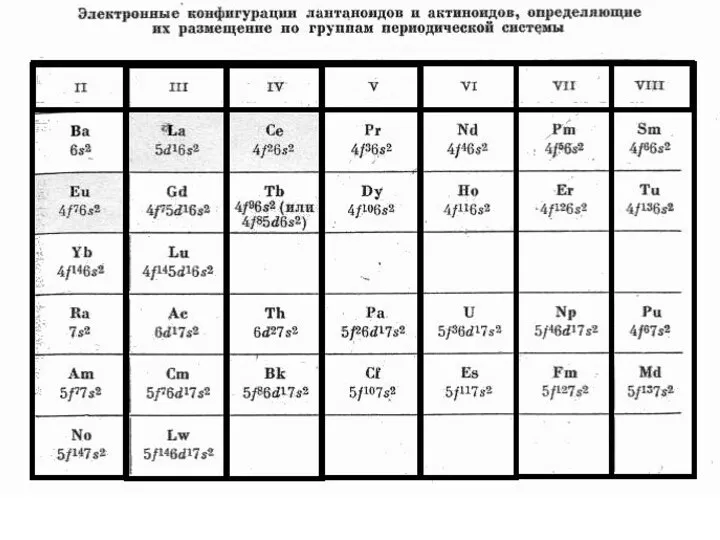
- 31. Следующий элемент периодической системы – скандий (21Sc). Где же располагается 21-й электрон? У атома скандия имеется
- 36. Скачать презентацию



















 Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Растворы. Массовая доля растворённого вещества
Растворы. Массовая доля растворённого вещества Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Растворы ВМС
Растворы ВМС Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Основания. 8 класс
Основания. 8 класс Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Вуглеводи. Загальна характеристика вуглеводів, представники
Вуглеводи. Загальна характеристика вуглеводів, представники Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Дефекты в твердых телах
Дефекты в твердых телах Диеновые углеводороды CnH2n-2
Диеновые углеводороды CnH2n-2 Stirring in liquid media
Stirring in liquid media Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Гетероатомные соединения нефти
Гетероатомные соединения нефти Химия титанорганических соединений
Химия титанорганических соединений Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Теория диаграмм состояния
Теория диаграмм состояния Растворы. Термодинамика образования растворов. Растворимость веществ (Лекция 3)
Растворы. Термодинамика образования растворов. Растворимость веществ (Лекция 3) Biomass Feedstocks
Biomass Feedstocks Карбоновые кислоты
Карбоновые кислоты Олигомеризация олефинов
Олигомеризация олефинов Центрифугирование
Центрифугирование Indicatori di pH
Indicatori di pH Дослідження методів очищення висококольорових поверхневих вод
Дослідження методів очищення висококольорових поверхневих вод