Содержание
- 2. Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим
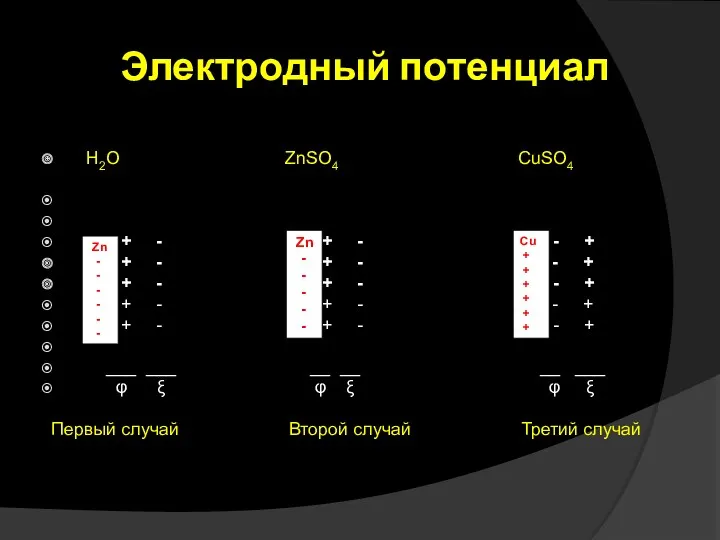
- 3. Электродный потенциал H2O ZnSO4 CuSO4 + - + - - + + - + - -
- 4. Первый случай Ионы металлического цинка, входящие в кристаллическую решетку под действием диполя воды отрываются и переходят
- 5. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом (Е). Он состоит из двух
- 6. Второй случай Аналогичный процесс будет протекать при погружении цинковой пластины в раствор соли цинка - ZnSO4.
- 7. Третий случай При погружении химически неактивного металла например меди, в раствор соли CuSO4 будет протекать процесс
- 8. Между пластинкой и раствором устанавливается окислительно-восстановительное равновесие: При погружении металла в раствор его соли
- 9. Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой, называется электродным потенциалом Е. Потенциалу металла приписывается
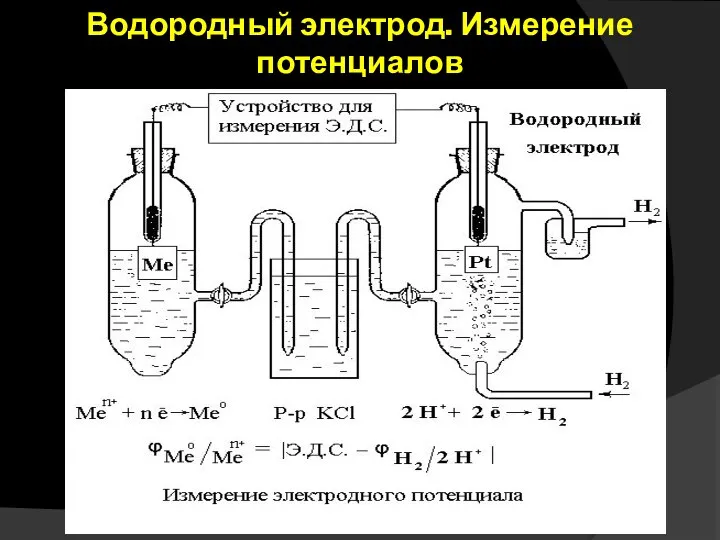
- 10. Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом
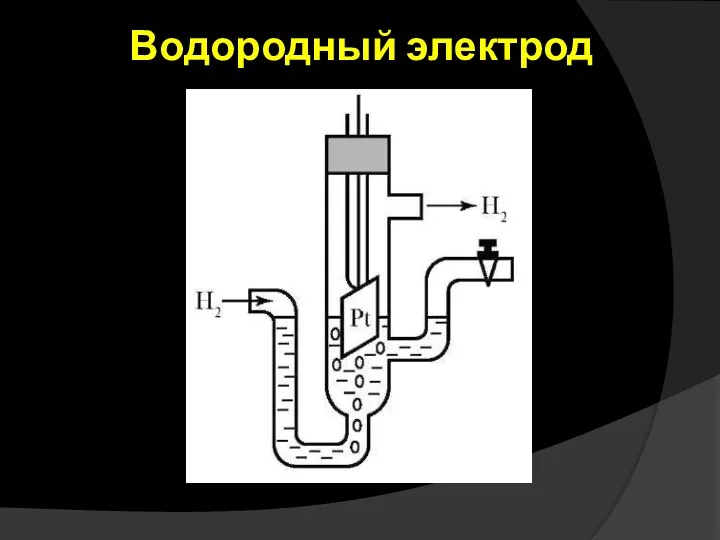
- 11. Водородный электрод
- 12. Он изготавливается из губчатой платины, погруженной в раствор H2SO4 c активностью ионов водорода1 моль/л. Через раствор
- 13. Равновесие характеризуется определенным значением скачка потенциала на межфазной границе. Электродный потенциал, отвечающий данным условиям, получил название
- 14. Водородный электрод. Измерение потенциалов
- 15. Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ,
- 16. Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом. Выделяя
- 17. а) - чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих
- 18. При обратимом протекании химической реакции в гальваническом элементе совершаемая системой электрическая работа определяется Wmax= – ΔG
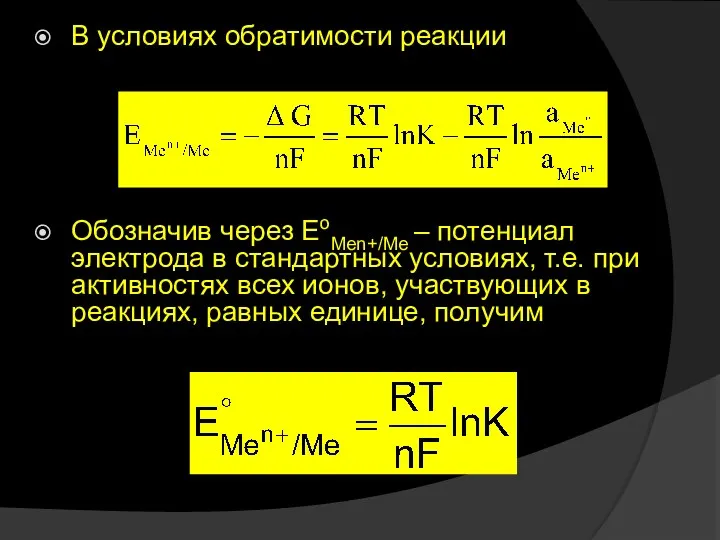
- 19. В условиях обратимости реакции Обозначив через EoMen+/Me – потенциал электрода в стандартных условиях, т.е. при активностях
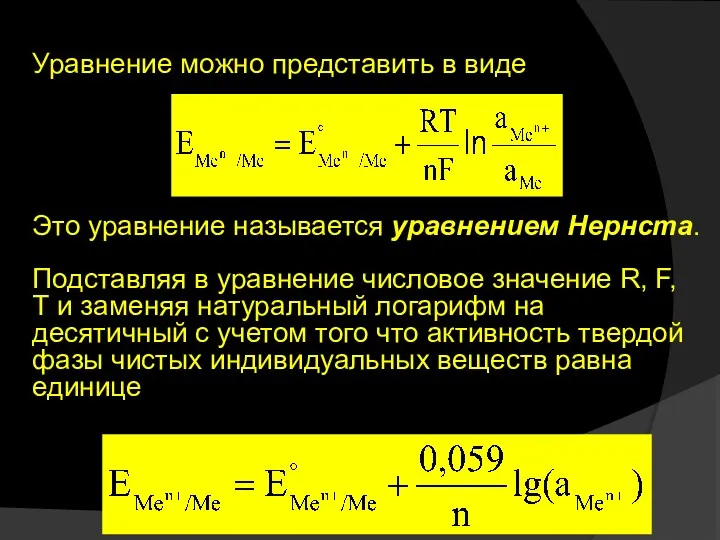
- 20. Уравнение можно представить в виде Это уравнение называется уравнением Нернста. Подставляя в уравнение числовое значение R,
- 21. Вальтер Фридрих Герман Нернст (1864-1941)
- 22. Например, для окислительно-восстановительной системы уравнение Нернста имеет вид
- 24. Ячейка для измерения электродного потенциала (элемент Якоби-Даниэля) – устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно
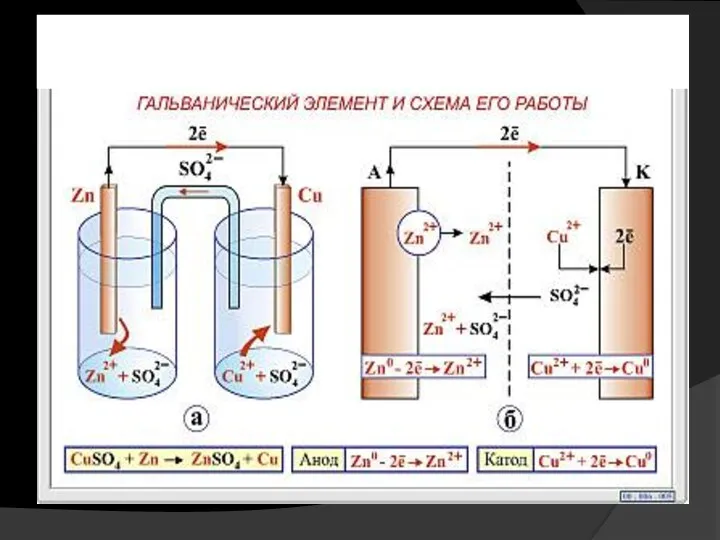
- 25. Гальванический элемент состоит из двух полуэлементов (ОВС), соединенных между собой металлическим проводником и солевым мостиком. Процесс
- 26. Электроны от анода по внешней цели протекают к катоду. Соответствующая схема такого гальванического элемента записывается следующим
- 27. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением
- 28. ЭЛЕКТРОЛИЗ Электролиз – окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита.
- 29. Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита,
- 30. анод катод
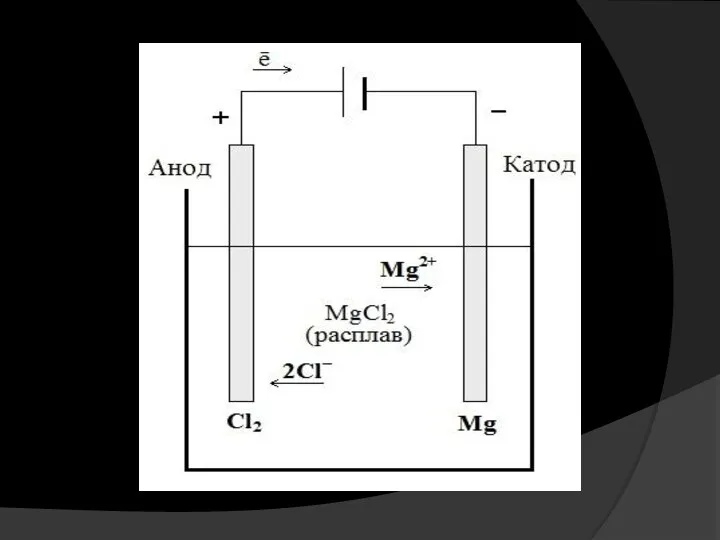
- 31. При высоких температурах расплав соли диссоциирует на ионы: Прохождение электрического тока через расплав обусловлено тремя одновременно
- 32. Суммарное уравнение электролиза после уравнивания числа отдаваемых и присоединенных электронов принимает вид: Схематически весь процесс можно
- 33. Электролиз расплава Na2SO4 Схематически весь процесс можно представить следующим образом: Катод (-) Анод ( + )
- 34. Электролиз растворов электролитов Электролиз растворов электролитов более сложен из-за возможности участия в электродных процессах молекул воды
- 35. Для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться следующими практическими
- 36. Катод. 1. В первую очередь восстанавливаются катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода,
- 37. Анод. Характер окислительных процессов зависит также от материала электродов. Различают нерастворимые (инертные) и растворимые (активные) электроды.
- 38. В первую очередь окисляются простые анионы в порядке возрастания их Ео, не превышающих + 1,5 В
- 39. При использовании растворимых анодов (из Cu, Zn, Ag, Ni и др. металлов) электроны во внешнюю цель
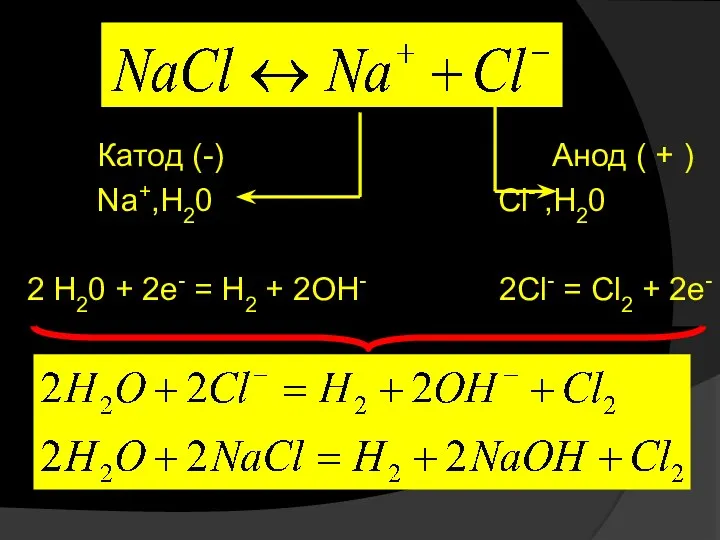
- 40. Катод (-) Анод ( + ) Na+,H20 Cl- ,H20 2 H20 + 2e- = H2 +
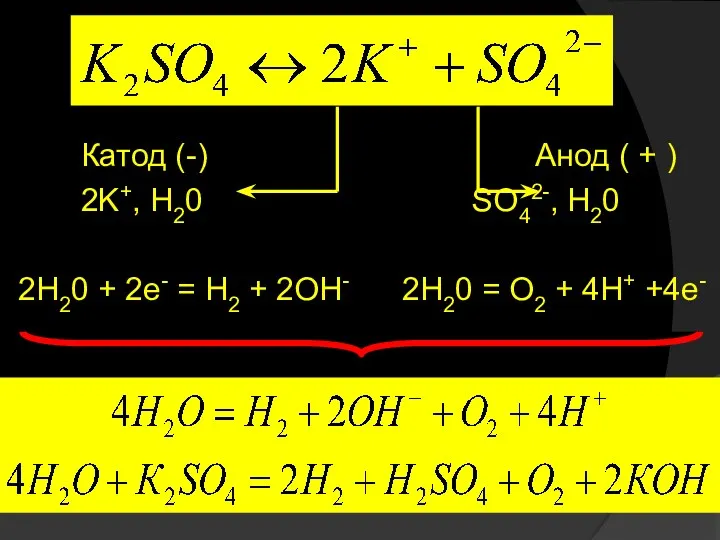
- 41. Катод (-) Анод ( + ) 2K+, H20 SO42-, H20 2H20 + 2e- = H2 +
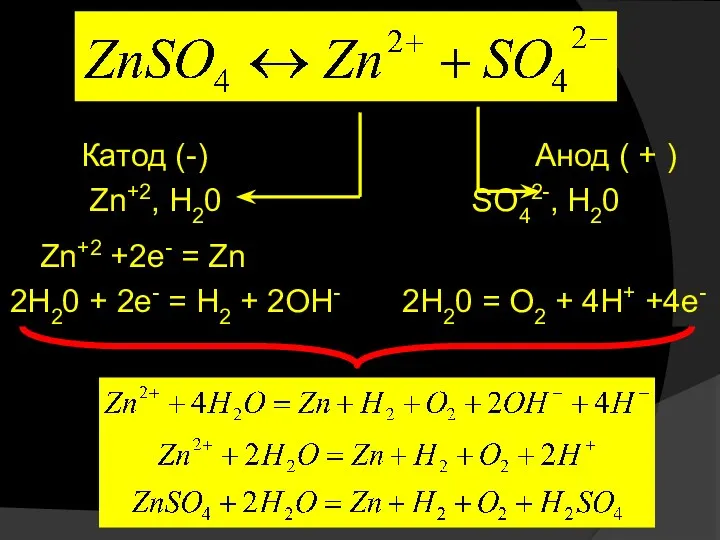
- 42. Катод (-) Анод ( + ) Zn+2, H20 SO42-, H20 Zn+2 +2e- = Zn 2H20 +
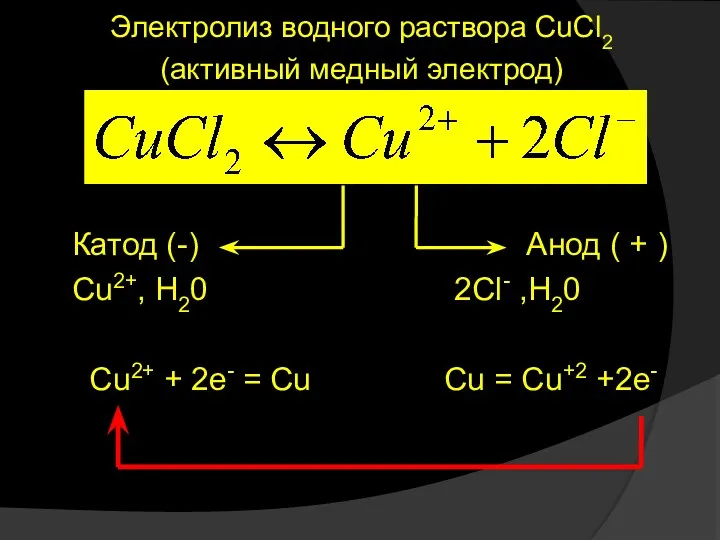
- 43. Электролиз водного раствора CuCl2 (активный медный электрод) Катод (-) Анод ( + ) Cu2+, H20 2Cl-
- 44. Количественные характеристики электролитических процессов устанавливаются двумя законами Фарадея: Масса веществ, выделившихся на электродах при электролизе, прямо
- 45. Экспериментально установлено, что для выделения на электроде одной молярной массы эквивалента вещества необходимо затратить одно и
- 46. где m – масса окисленного или восстановленного вещества, г; МЭ – молярная масса его эквивалента, г/моль;
- 47. Показателем эффективности электролиза является выход по току η, %, определяемый как отношение массы вещества, фактически полученной
- 49. Скачать презентацию



































 Своя игра по химии
Своя игра по химии Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Равновесные электрохимические системы
Равновесные электрохимические системы Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Белки. Определение
Белки. Определение Химическая термодинамика. Фазовые равновесия
Химическая термодинамика. Фазовые равновесия Первичная переработка нефти
Первичная переработка нефти Азотистая кислота
Азотистая кислота Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Валентность и степень окисления атомов в молекуле
Валентность и степень окисления атомов в молекуле Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Основные понятия и законы химии
Основные понятия и законы химии Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Понятие биогенности химических элементов
Понятие биогенности химических элементов Реакции ионного обмена
Реакции ионного обмена Умные полимеры в биотехнологии и медицине
Умные полимеры в биотехнологии и медицине Неорганическая химия
Неорганическая химия Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Химия и война. Альманах
Химия и война. Альманах Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12
Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12 Фосфор и его соединения
Фосфор и его соединения Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее? Переработка угля
Переработка угля Знаки вторичной переработки
Знаки вторичной переработки Серная кислота H2SO4
Серная кислота H2SO4 Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов