Содержание
- 2. Амедео Авогадро (1776-1856) Итальянский физик и химик. Установил, что вода имеет химическую формулу Н2О, ввел термин
- 3. Амедео Авогадро (1776-1856) Итальянский физик и химик. Установил, что вода имеет химическую формулу Н2О, ввел термин
- 4. Для газов:
- 5. 1. Масса 1 л оксида серы (IV) при н. у: 1) 0,35 г; 3)2,86 г; 2)
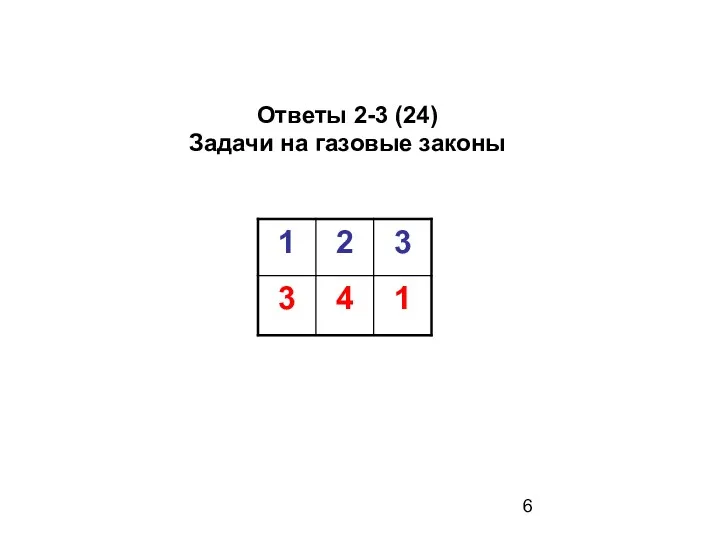
- 6. Ответы 2-3 (24) Задачи на газовые законы
- 7. Плотность газа по водороду показывает во сколько раз 1моль газа (или смеси газов) тяжелее, чем 1
- 8. Плотность газа по воздуху показывает во сколько раз 1моль газа (или смеси газов) тяжелее, чем 1
- 9. 1. Найти плотность аммиака по: а) углекислому газу б) водороду 2. Найти плотность водорода по: а)
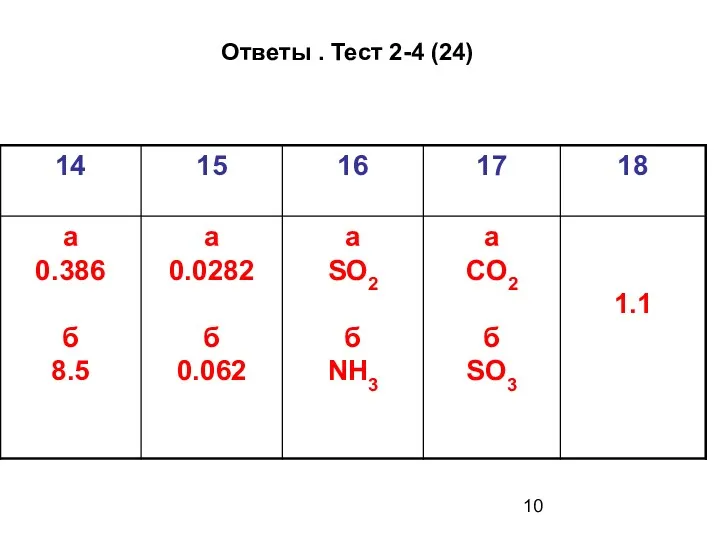
- 10. Ответы . Тест 2-4 (24)
- 11. Плотность газа (смеси газов) - ρ (г/л, г/дм3) – масса 1л газа (смеси газов)
- 12. 1. Определить газ, если а) ρ = 3.571 г/л б) ρ = 3.17 г/л в) ρ
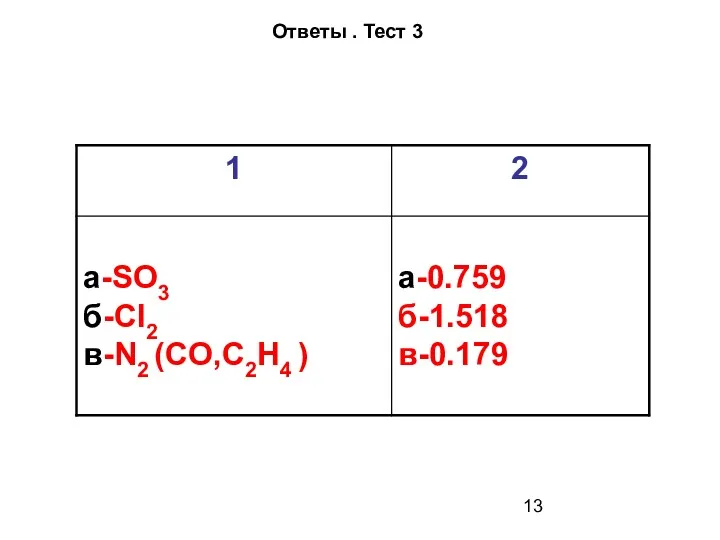
- 13. Ответы . Тест 3
- 14. Закон Менделеева-Клайперона
- 15. Использование газовых законов для расчетных задач
- 16. Запомним! 1) переход от градусов по Цельсию на градусы по Кельвину: 2) 3) Р0 = 101.325
- 17. Задача. В баллоне объемом 50 л при 200С находится аргон под давлением 80 атм. Масса этого
- 18. 1. 2KMnO4 + 16HCI → 2MnCI2 + 5CI2↑ + 2KCI + 8H2O 2. K2Cr2O7 +14HCI →
- 19. 1. Взорвали смесь 2 л водорода и 12 л хлора. Объём смеси оказался равен ____л. 2.
- 21. Скачать презентацию















 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей