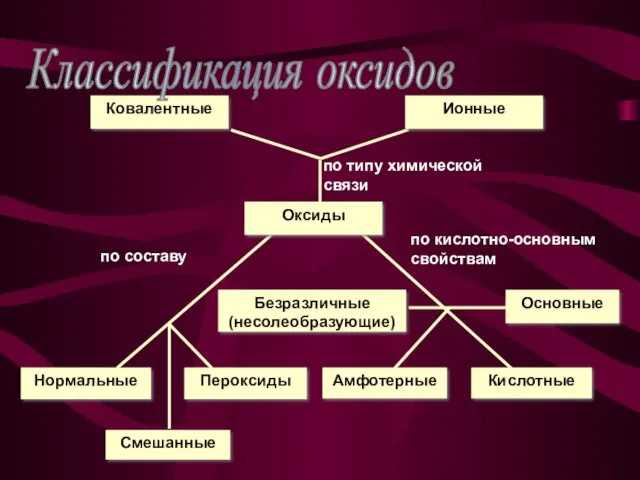
Нормальные оксиды – оксиды, в которых есть только связи между кислородом
и каким-нибудь элементом. Примеры: MgO, SO3 , SiO2;
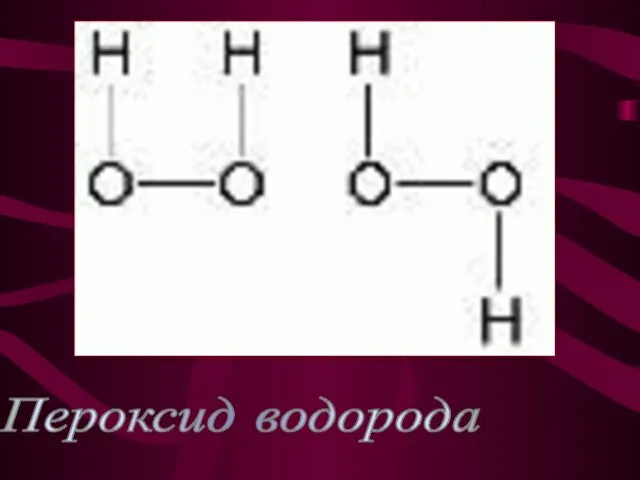
Пероксиды – оксиды, в которых есть связи между двумя атомами кислорода. Примеры: Na2O2, H2O2;
Смешанные оксиды – оксиды, которые представляют собой смесь двух одного элемента в разных степенях окисления. Примеры:Pb3O4 = 2PbO + PbO2;Fe3O4 = FeO + Fe2O3
Кислотные оксиды (ангидриды) – оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами образуют соли. Примеры: SO3, SO2, Mn2O7;
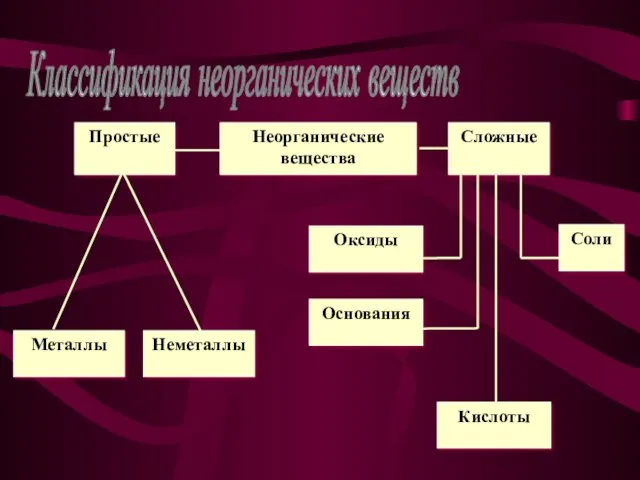
Классификация оксидов









 Спирты
Спирты Степень окисления
Степень окисления Галогены (солеобразующие)
Галогены (солеобразующие) Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Азотная кислота и ее свойства
Азотная кислота и ее свойства Ароматы, запахи, флюиды
Ароматы, запахи, флюиды Три правила взаимодействия элементов симметрии
Три правила взаимодействия элементов симметрии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Реакционная способность соединений со связью углерод-гетероатом
Реакционная способность соединений со связью углерод-гетероатом Гидроксипроизводные углеводородов. Спирты. Фенолы
Гидроксипроизводные углеводородов. Спирты. Фенолы Горение жидкого топлива
Горение жидкого топлива Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Минералы горных пород
Минералы горных пород Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Коллоидная химия. Введение
Коллоидная химия. Введение Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Оксид меди
Оксид меди Imperfections in Solids
Imperfections in Solids Международный Год периодической таблицы химических элементов
Международный Год периодической таблицы химических элементов Crystal defects and imperfections
Crystal defects and imperfections Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Материаловедение в полиграфическом и упаковочном производстве
Материаловедение в полиграфическом и упаковочном производстве Карбоновые кислоты, их нахождение в природе и применение
Карбоновые кислоты, их нахождение в природе и применение Класифікація, будова та номенклатура органічних сполук
Класифікація, будова та номенклатура органічних сполук Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Чистые вещества и смеси
Чистые вещества и смеси Жидкостная хроматография
Жидкостная хроматография