Содержание
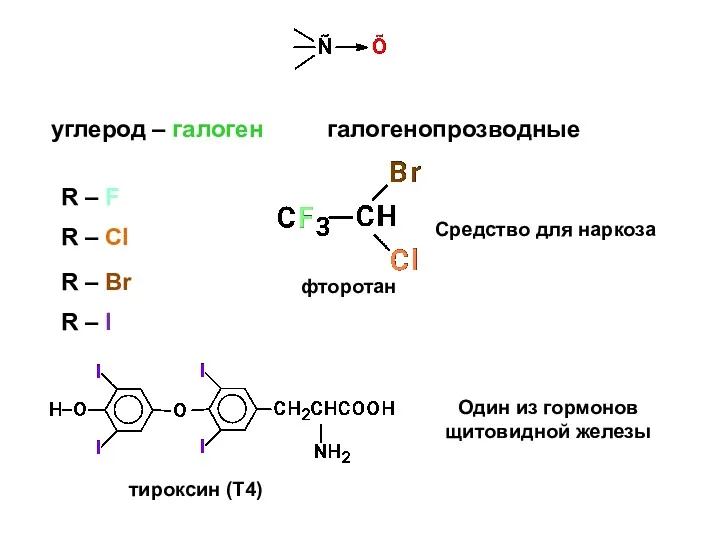
- 2. фторотан Один из гормонов щитовидной железы углерод – галоген галогенопрозводные R – F R – Cl
- 3. углерод-кислород
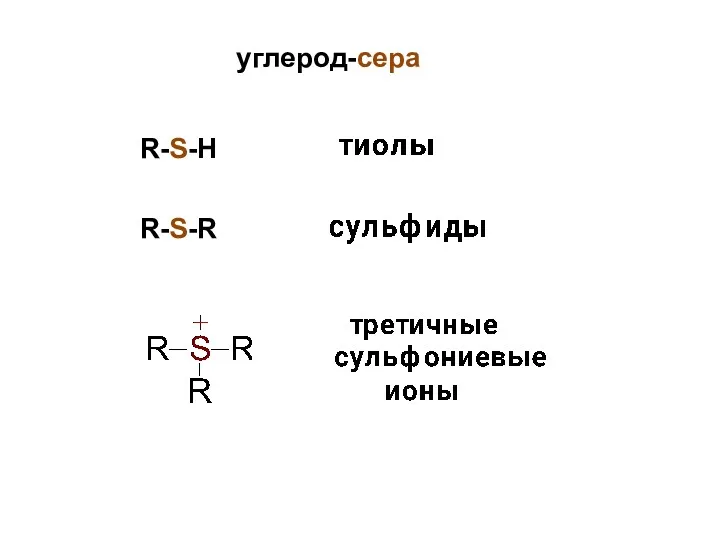
- 4. углерод-сера R-S-H R-S-R
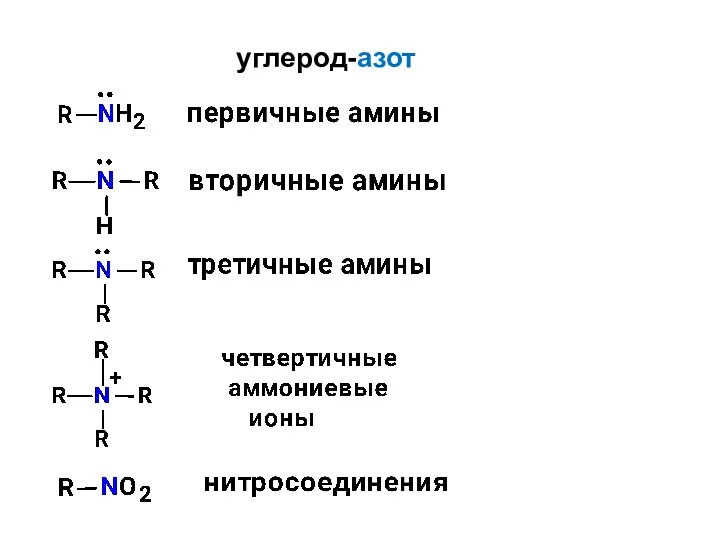
- 5. углерод-азот
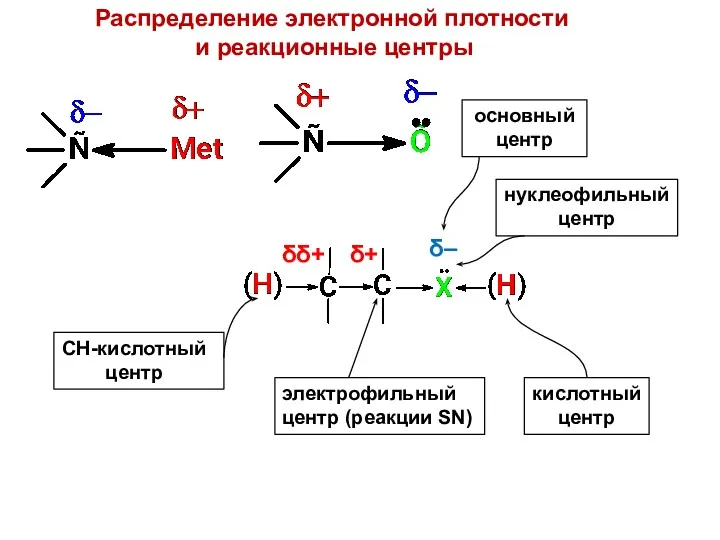
- 6. δ– δ+ δδ+ СН-кислотный центр электрофильный центр (реакции SN) кислотный центр основный центр нуклеофильный центр Распределение
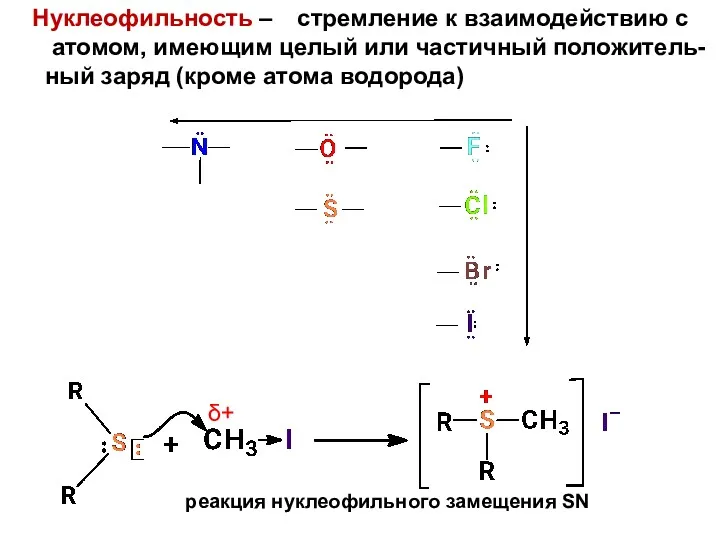
- 7. Нуклеофильность – стремление к взаимодействию с атомом, имеющим целый или частичный положитель- ный заряд (кроме атома
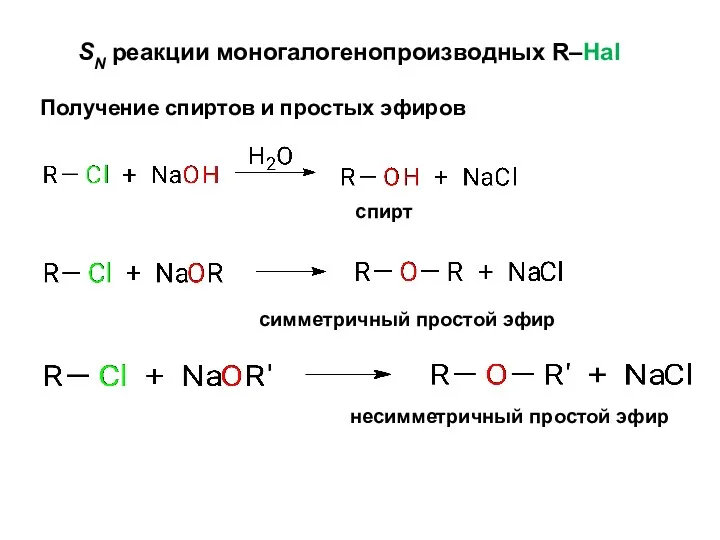
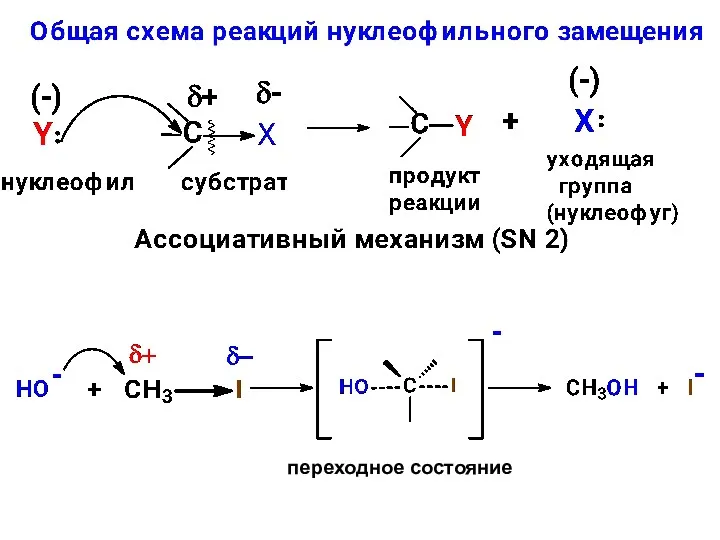
- 8. SN реакции моногалогенопроизводных R–Hal Получение спиртов и простых эфиров спирт симметричный простой эфир несимметричный простой эфир
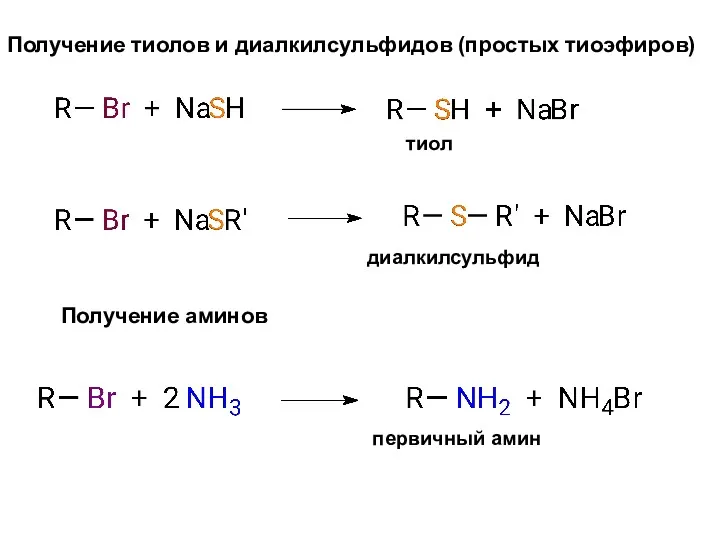
- 9. Получение тиолов и диалкилсульфидов (простых тиоэфиров) Получение аминов тиол диалкилсульфид первичный амин
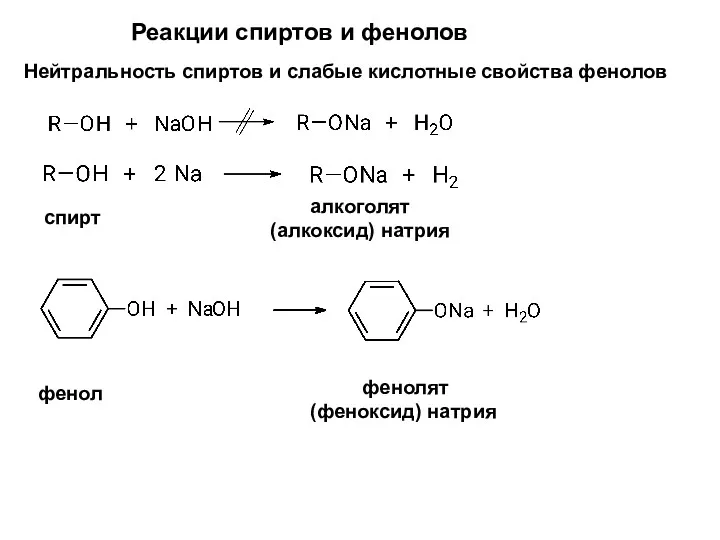
- 10. Реакции спиртов и фенолов Нейтральность спиртов и слабые кислотные свойства фенолов спирт алкоголят (алкоксид) натрия фенол
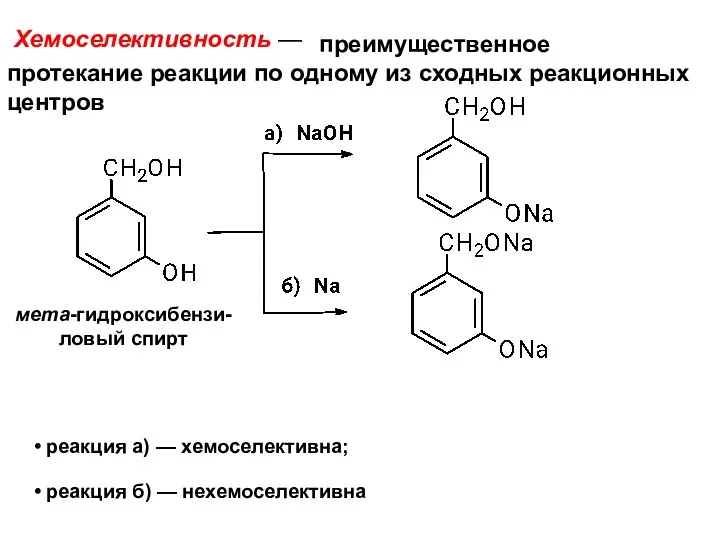
- 11. Хемоселективность — реакция а) — хемоселективна; реакция б) — нехемоселективна преимущественное протекание реакции по одному из
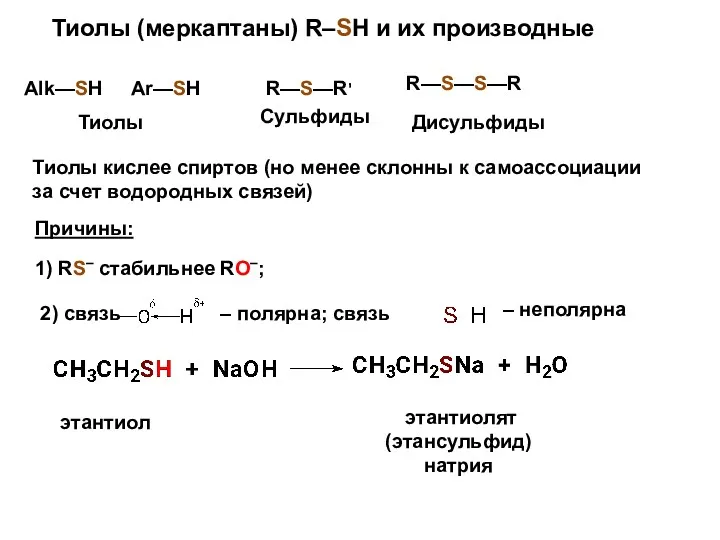
- 12. Тиолы (меркаптаны) R–SH и их производные Alk—SH Ar—SH R—S—R' R—S—S—R Тиолы Сульфиды Дисульфиды Тиолы кислее спиртов
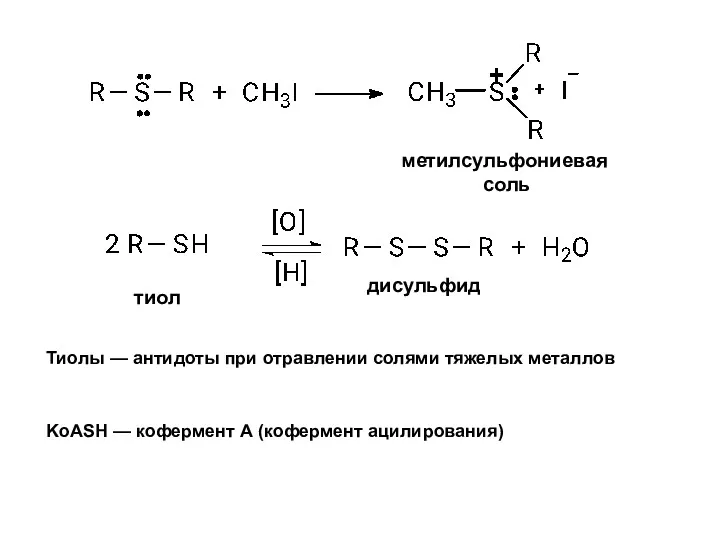
- 13. Тиолы — антидоты при отравлении солями тяжелых металлов KoASH — кофермент А (кофермент ацилирования) метилсульфониевая соль
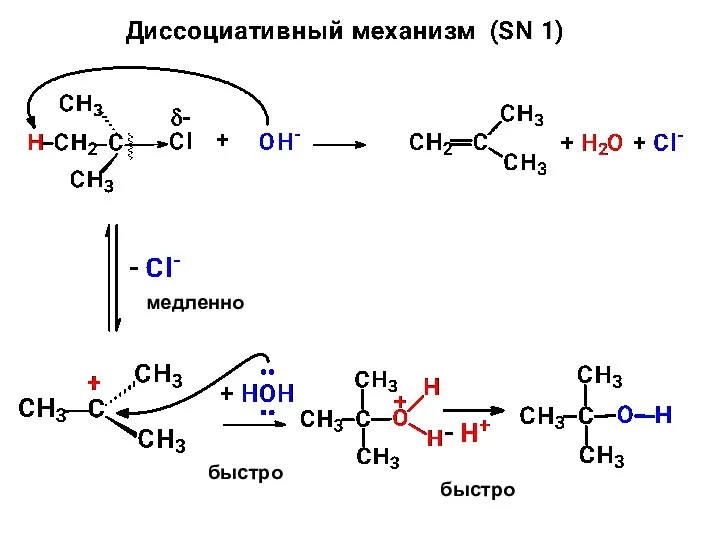
- 14. переходное состояние
- 15. медленно быстро быстро
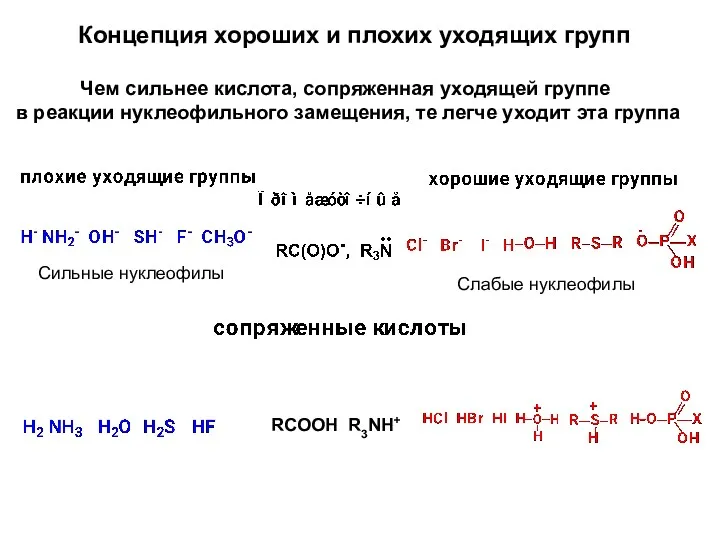
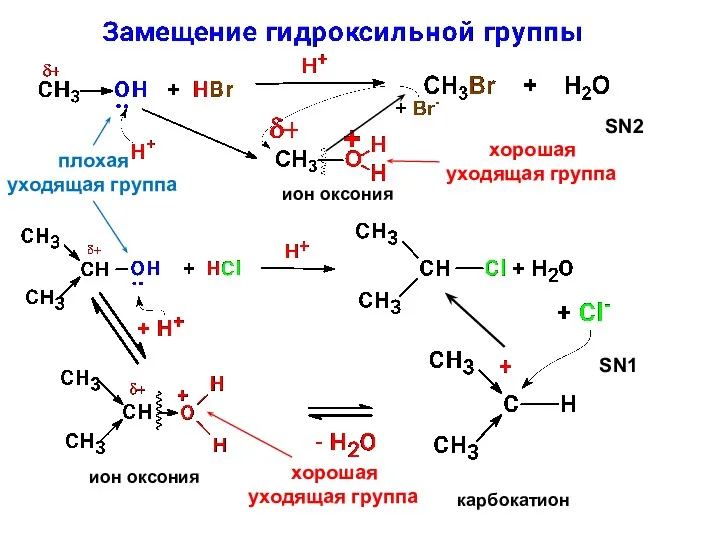
- 16. Концепция хороших и плохих уходящих групп Чем сильнее кислота, сопряженная уходящей группе в реакции нуклеофильного замещения,
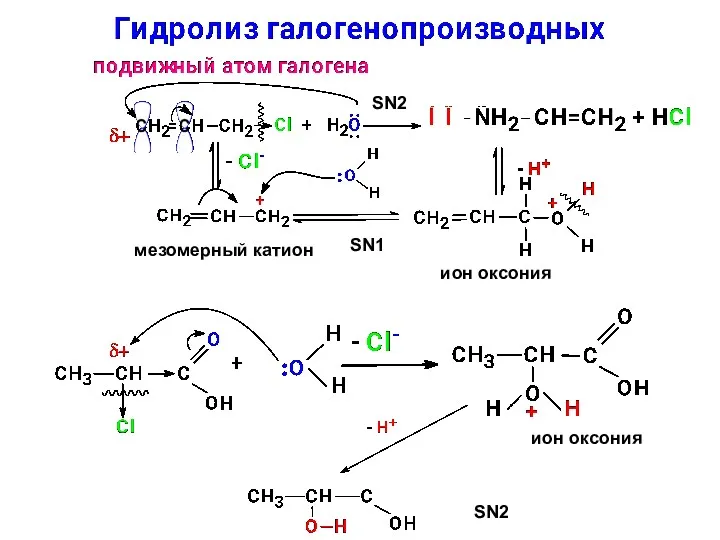
- 17. SN2 мезомерный катион ион оксония SN1 ион оксония SN2
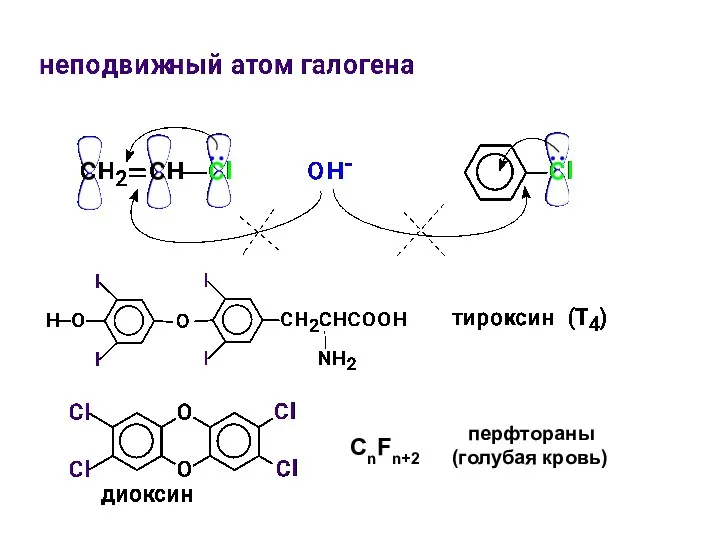
- 18. Соединения с обычной подвижностью атома галогена Этилхлорид CH3CH2Cl – местноанестезирующее средство. Хлороформ CHCl3 – средство для
- 19. CnFn+2 перфтораны (голубая кровь)
- 20. ион оксония ион оксония карбокатион SN1 плохая уходящая группа хорошая уходящая группа SN2 хорошая уходящая группа
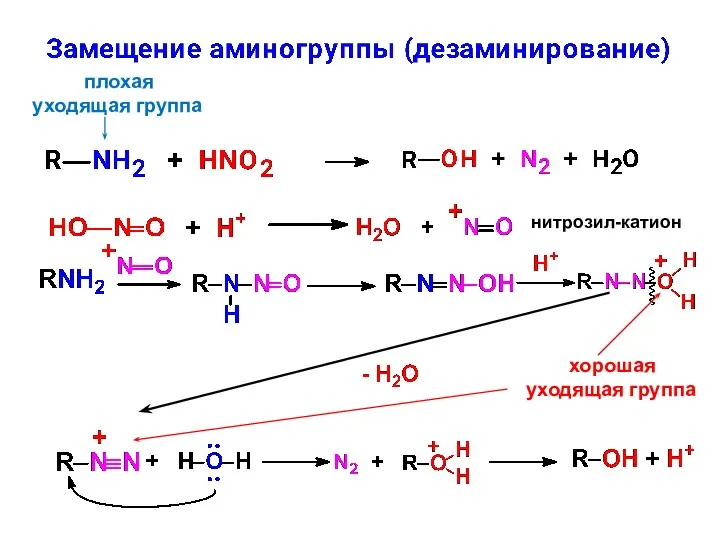
- 21. плохая уходящая группа нитрозил-катион хорошая уходящая группа
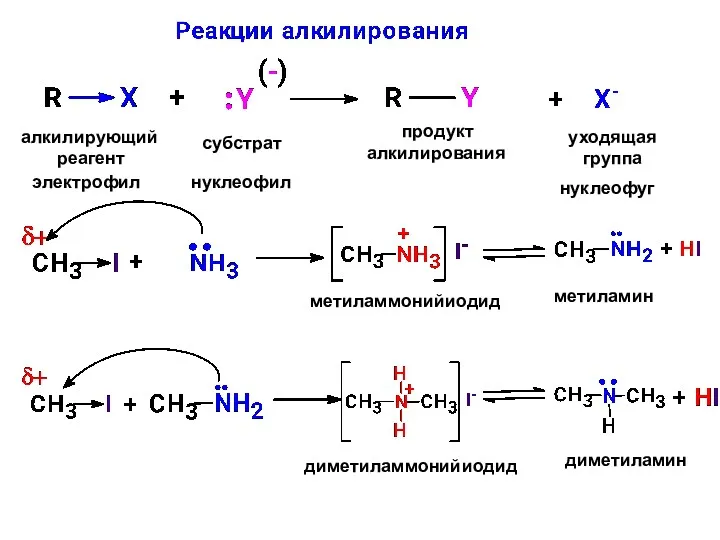
- 22. алкилирующий реагент субстрат продукт алкилирования уходящая группа электрофил нуклеофил нуклеофуг метиламмонийиодид метиламин диметиламмонийиодид диметиламин
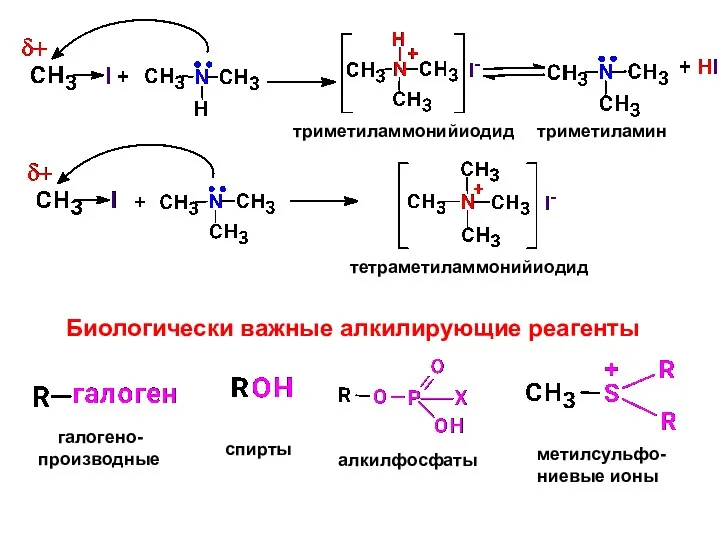
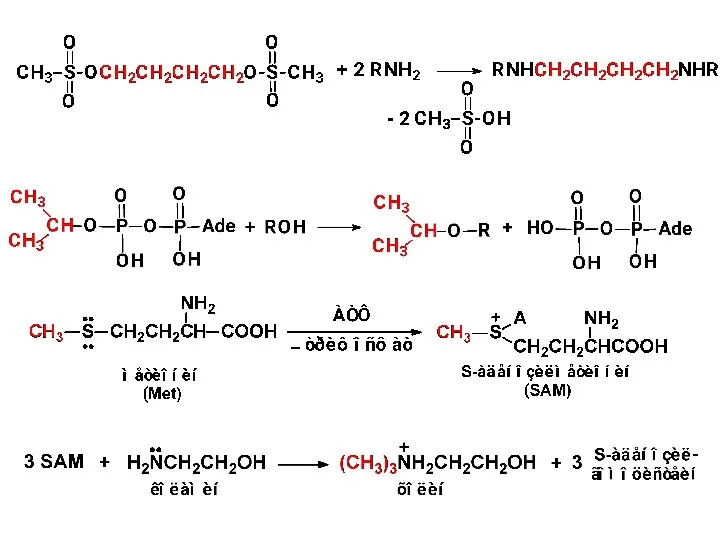
- 23. триметиламмонийиодид триметиламин тетраметиламмонийиодид Биологически важные алкилирующие реагенты галогено- производные спирты алкилфосфаты метилсульфо- ниевые ионы
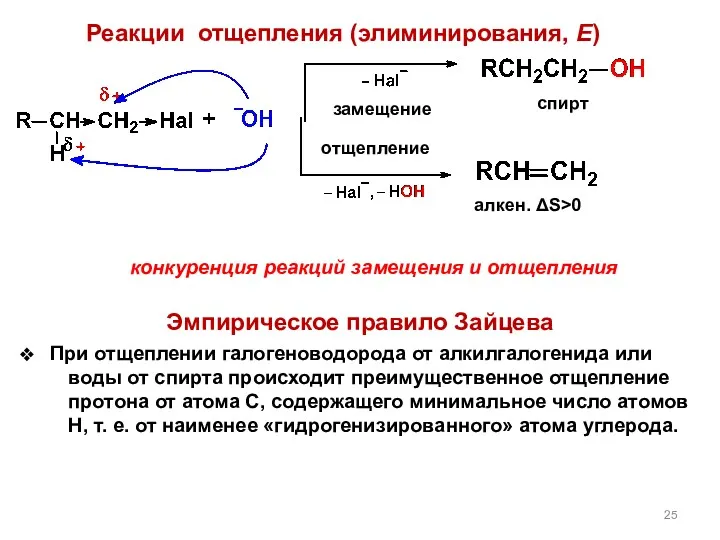
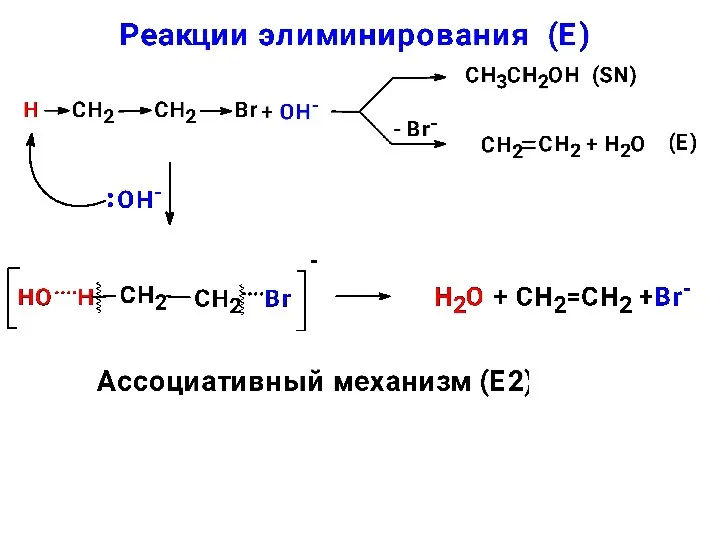
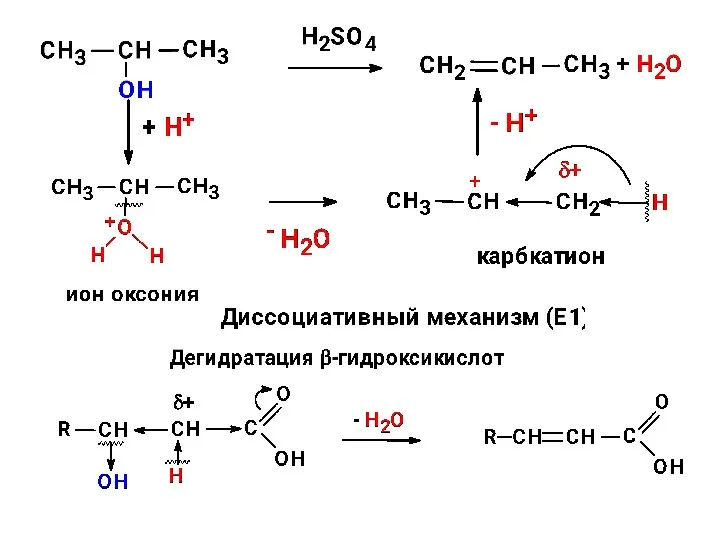
- 25. конкуренция реакций замещения и отщепления Эмпирическое правило Зайцева При отщеплении галогеноводорода от алкилгалогенида или воды от
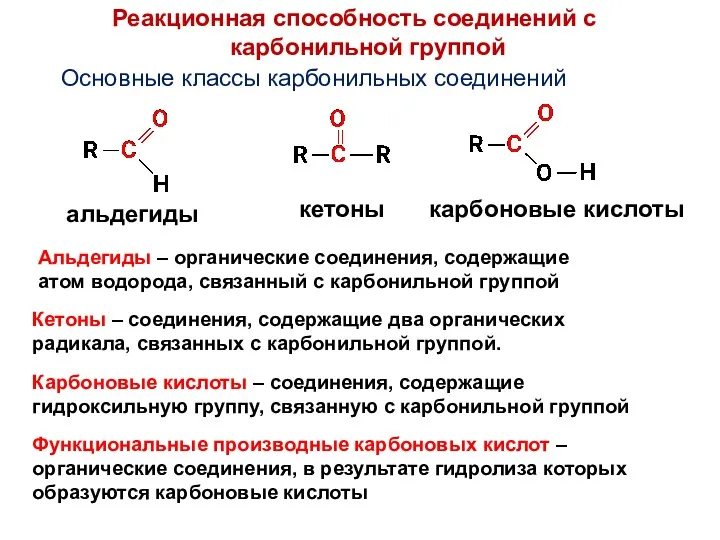
- 28. Основные классы карбонильных соединений альдегиды кетоны карбоновые кислоты Функциональные производные карбоновых кислот – органические соединения, в
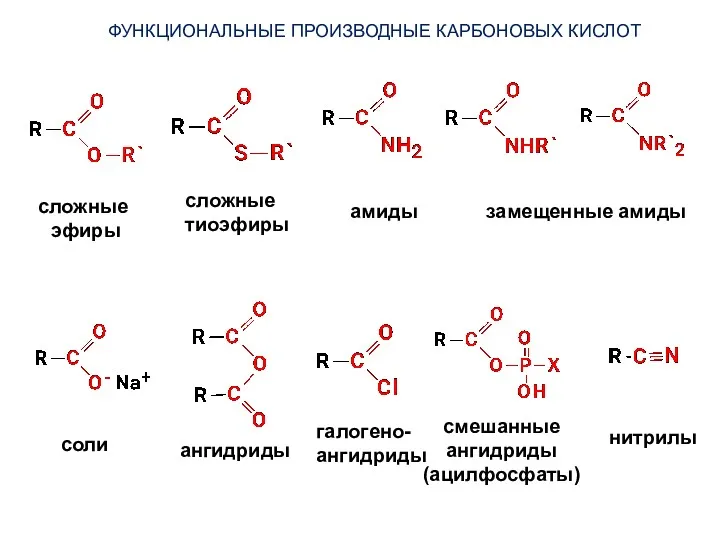
- 29. ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ сложные эфиры сложные тиоэфиры амиды замещенные амиды соли ангидриды галогено- ангидриды смешанные
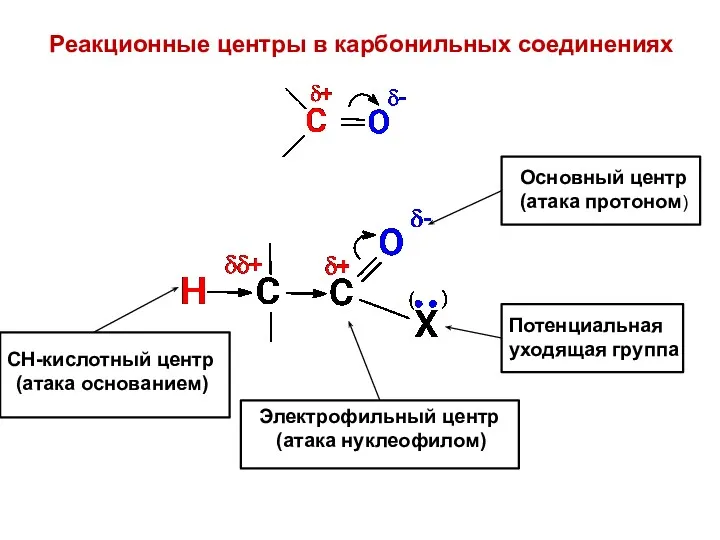
- 30. Реакционные центры в карбонильных соединениях СН-кислотный центр (атака основанием) Электрофильный центр (атака нуклеофилом) Основный центр (атака
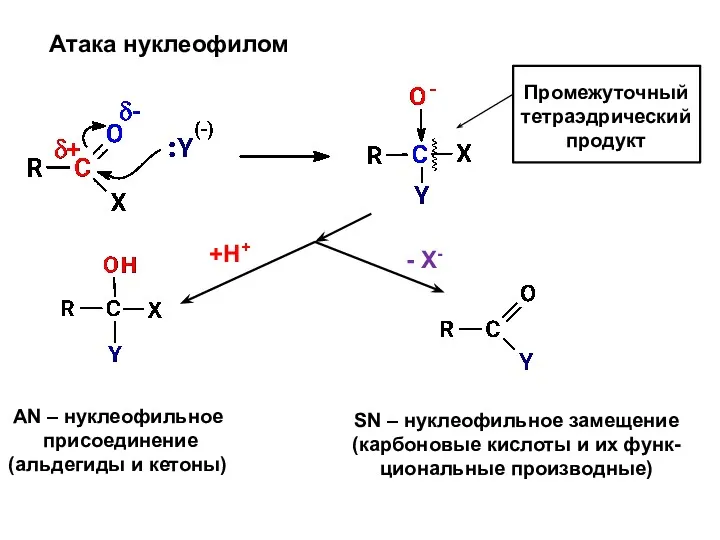
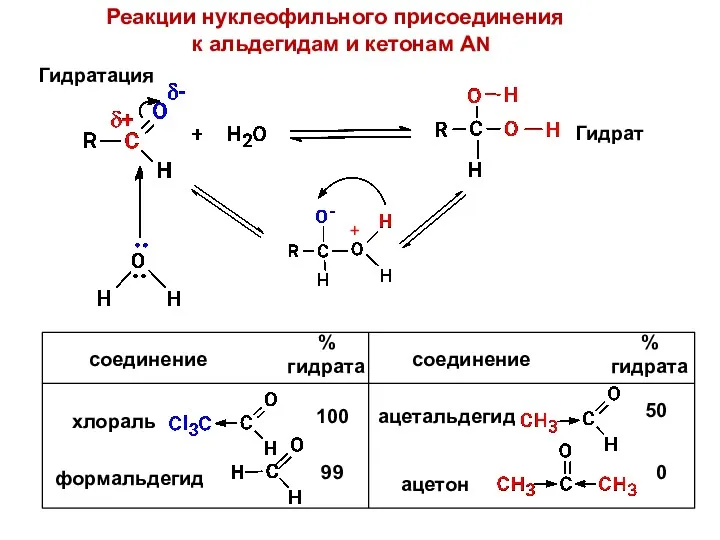
- 31. Атака нуклеофилом Промежуточный тетраэдрический продукт +Н+ - X- AN – нуклеофильное присоединение (альдегиды и кетоны) SN
- 32. Реакции нуклеофильного присоединения к альдегидам и кетонам AN Гидратация Гидрат 100 99 50 0 + соединение
- 34. Скачать презентацию


 Аминокислоты 2
Аминокислоты 2 Магний. Нахождение в природе
Магний. Нахождение в природе Цветные металлы и сплавы
Цветные металлы и сплавы Концентрации растворов
Концентрации растворов Небезпечні хімічні речовини
Небезпечні хімічні речовини Медь и её соединения
Медь и её соединения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Азотовмісні сполуки
Азотовмісні сполуки Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Изомерия и ее виды
Изомерия и ее виды Берилій
Берилій Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Алмазы. Бриллианты
Алмазы. Бриллианты Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность