Содержание
- 2. Электролитическая диссоциация то процесс распада молекул на ионы при растворении или плавлении. Классическая теория электролитической диссоциации
- 3. Вещества Электролиты Вещества, водные растворы или расплавы,которые проводят электрический ток (соли, щелочи, кислоты) Неэлектролиты Вещества, водные
- 4. Электролитическая диссоциация - это процесс распада электролита на ионы. NaCl -> Na+ + Cl- HCl ->
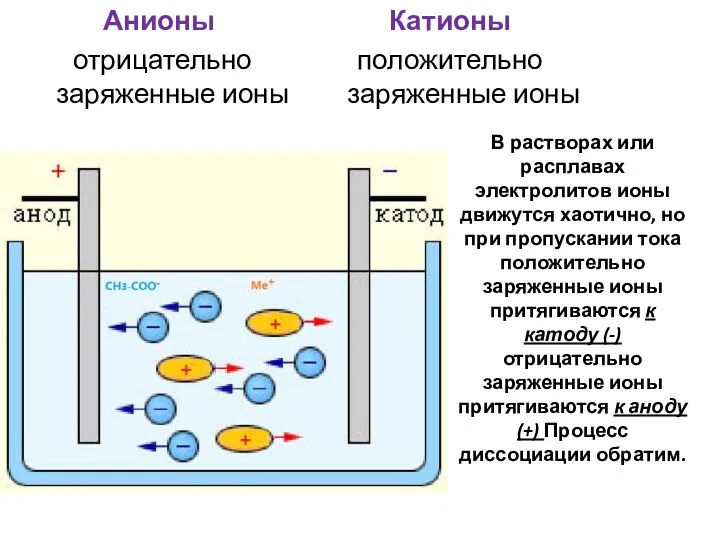
- 5. В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании тока положительно заряженные ионы притягиваются
- 6. Напишите уравнения электролитической диссоциации следующих солей: а) ZnCl2 б) Al(NO3)3 в) KНSO4 г) Na2CO3 д) KН2PO4
- 7. Тест «Выбери правильный ответ». 1. Катион - это: а) ион меди б) атом серы в) ион
- 9. Скачать презентацию





 Кластер Химические реакции
Кластер Химические реакции Петрография
Петрография Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Характеристика металу Ферум
Характеристика металу Ферум Художественная обработка камня
Художественная обработка камня Природный газ
Природный газ Алкени i Алкіни. Загальна та молекулярні формули, структурна ізомерія, систематична номенклатура
Алкени i Алкіни. Загальна та молекулярні формули, структурна ізомерія, систематична номенклатура Тұндыру әдістері
Тұндыру әдістері Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Коррозия металлов
Коррозия металлов Химический состав клетки. Вода
Химический состав клетки. Вода Алюминий IIIА топ элементі
Алюминий IIIА топ элементі 20231002_ammiak
20231002_ammiak Етери та естери
Етери та естери Карбонаты и гидрокарбонаты. Тест – экспресс
Карбонаты и гидрокарбонаты. Тест – экспресс Алкины. Гомологический ряд
Алкины. Гомологический ряд Понятие биогенности химических элементов
Понятие биогенности химических элементов Вивчення властивостей полімерів і синтетичних волокон. Лабораторна робота
Вивчення властивостей полімерів і синтетичних волокон. Лабораторна робота Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Физические и химические явления
Физические и химические явления Хроматографические методы анализа
Хроматографические методы анализа ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Химический элемент. Неон
Химический элемент. Неон Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода