Содержание
- 2. Эта история произошла во время I Мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого
- 3. Это вещество имеет древнюю историю. Арабские алхимики получали бесцветные кристаллы из оазиса Амон, находившегося около храма.
- 4. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый-химик, академик
- 5. История открытия аммиака Аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Луи
- 6. 1723-1802 г. В 1784 французский химик Бертолле разложением аммиака доказал его элементный состав, который в 1787
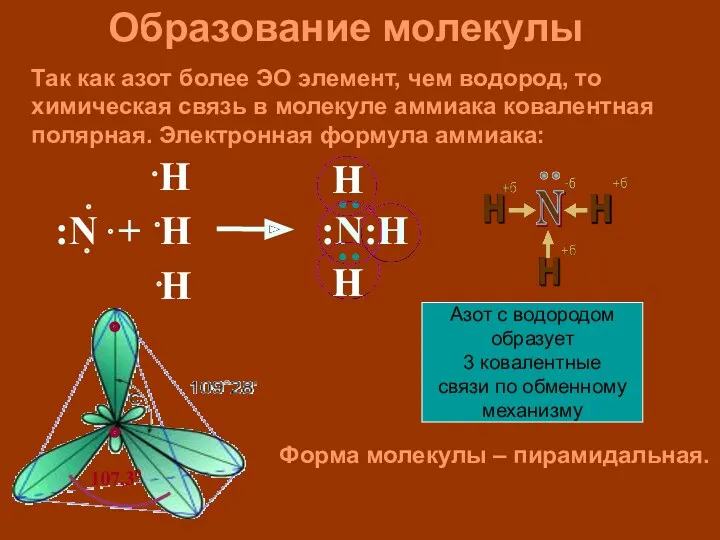
- 7. Так как азот более ЭО элемент, чем водород, то химическая связь в молекуле аммиака ковалентная полярная.
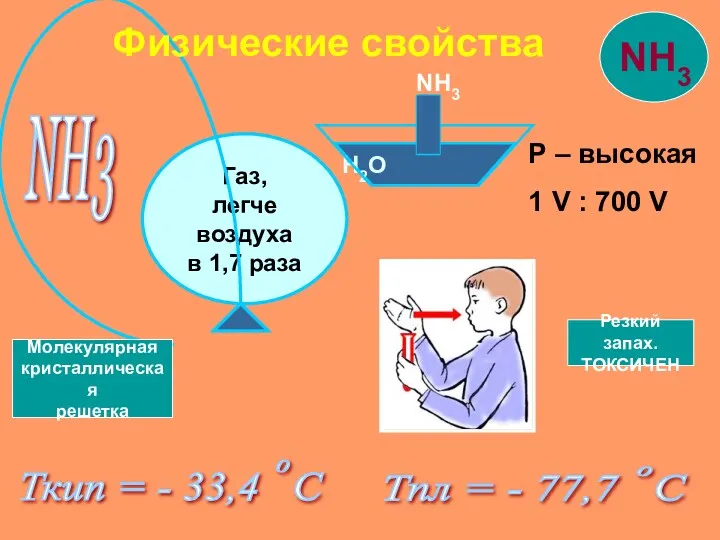
- 8. NH3 Р – высокая 1 V : 700 V Ткип = - 33,4 С Тпл =
- 9. 1. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. 2. При отравлении
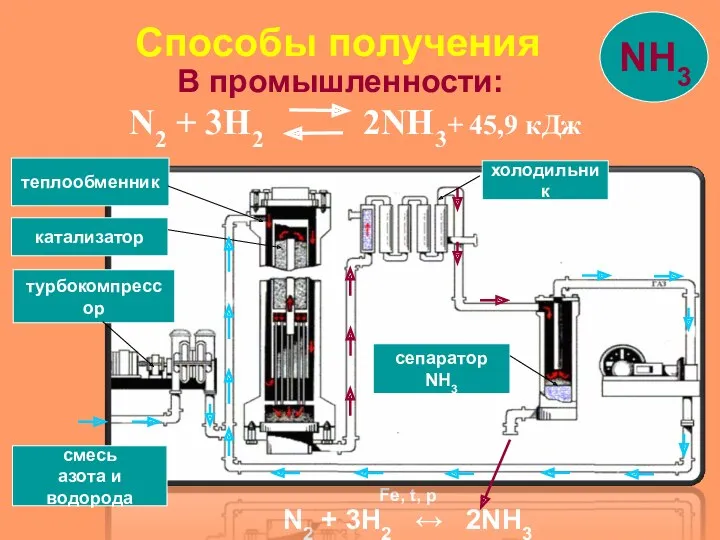
- 10. В промышленности: N2 + 3H2 2NH3+ 45,9 кДж смесь азота и водорода турбокомпрессор катализатор теплообменник холодильник
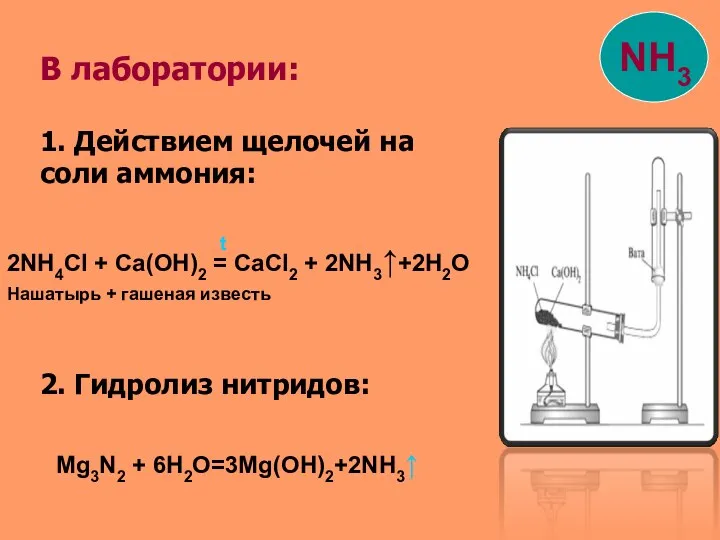
- 11. В лаборатории: 1. Действием щелочей на соли аммония: 2. Гидролиз нитридов:
- 12. Реакция горения аммиака (до N2): = Аммиак-восстановитель
- 13. Каталитическое окисление аммиака (до NO): Аммиак-восстановитель
- 14. Специфические свойства 1. Взаимодействие с гипохлоритом натрия (образование гидразина): 2NH3 + NaClO = N2H4 + NaCl+H2O
- 15. Обобщение
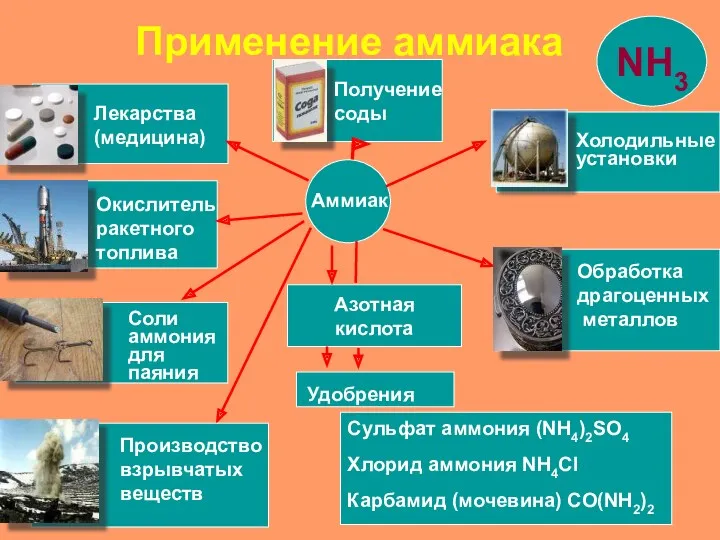
- 16. Азотная кислота Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиак Удобрения Лекарства (медицина) Окислитель
- 17. Техногенные катастрофы
- 18. Осуществите цепочку превращений: N2?NH3?(NH4)2SO4?NH4Cl?NH3 ?N2 ? Li3N Домашнее задание: §17 стр. 52. задача №2. Готовимся к
- 20. Скачать презентацию












 Введение в ЭТМ и основы строения и свойств материалов. (1)
Введение в ЭТМ и основы строения и свойств материалов. (1) Окислы и их свойства
Окислы и их свойства Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Роль воды в химических реакциях
Роль воды в химических реакциях Сера и ее соединения
Сера и ее соединения Химия s-элементов. Общая характеристика
Химия s-элементов. Общая характеристика Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура
Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5)
Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5) Химические свойства воды
Химические свойства воды Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Валентность и степень окисления
Валентность и степень окисления Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Химическая промышленность
Химическая промышленность Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии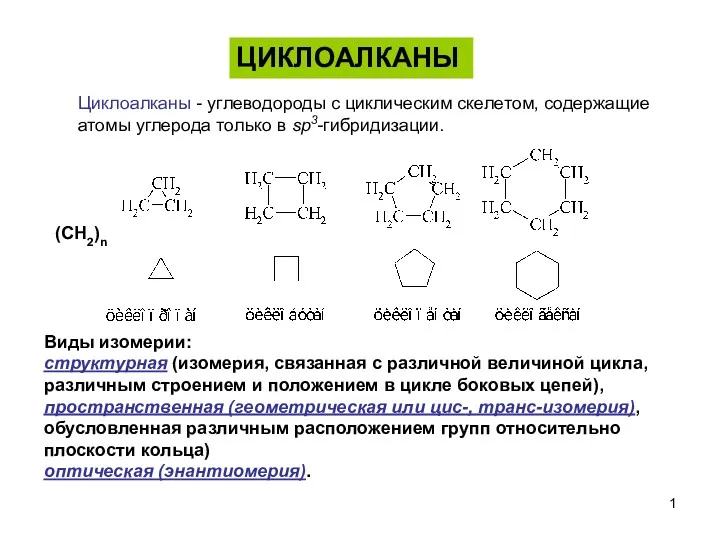 Циклоалканы
Циклоалканы Ионная химическая связь
Ионная химическая связь Применение водорода. Будущие водородные технологии. Урок химии в 8 классе
Применение водорода. Будущие водородные технологии. Урок химии в 8 классе Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Химическая связь и ее типы. Основные классы неорганических соединений
Химическая связь и ее типы. Основные классы неорганических соединений Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Основные характеристики клеев
Основные характеристики клеев Задачи
Задачи Химический состав клетки
Химический состав клетки Аллотропия
Аллотропия