Содержание
- 2. План лекции 3 Основные типы химической связи, механизм их образования и свойства: ковалентная, ионная, металлическая, водородная
- 3. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы 3
- 4. Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих электронных пар 4 Параметры
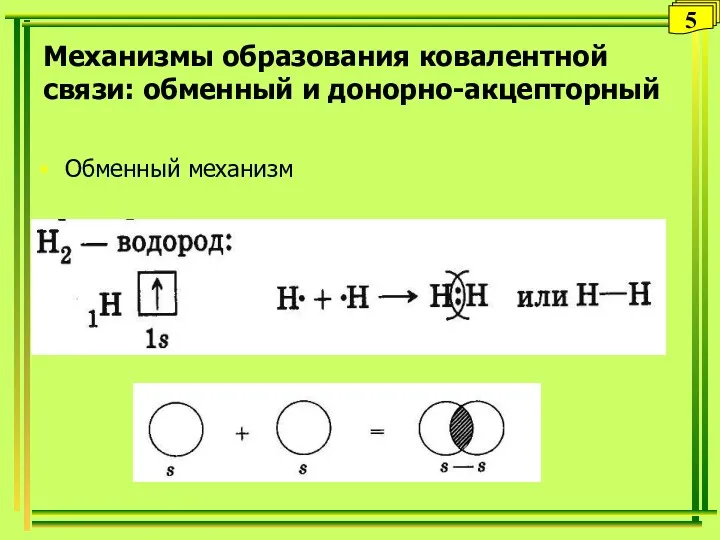
- 5. Обменный механизм 5 Механизмы образования ковалентной связи: обменный и донорно-акцепторный
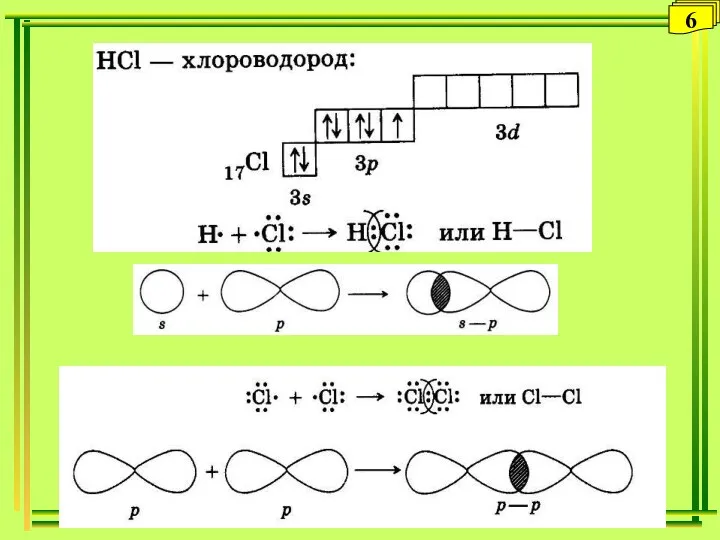
- 6. 6
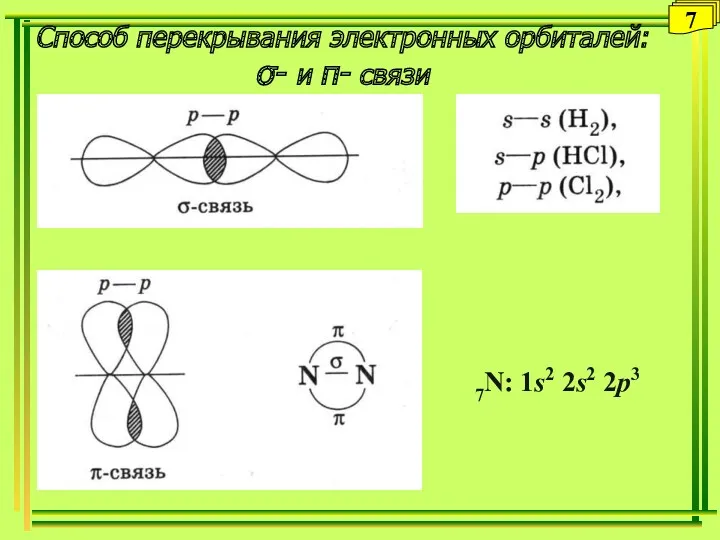
- 7. Способ перекрывания электронных орбиталей: σ- и π- связи 7 7N: 1s2 2s2 2p3
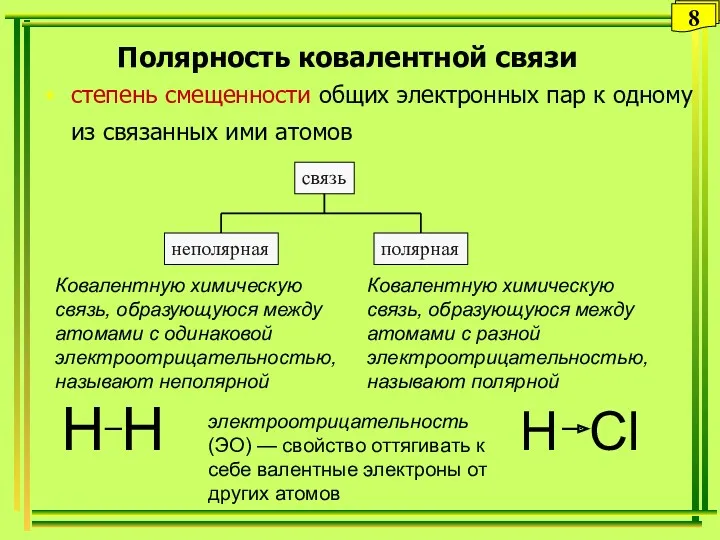
- 8. Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов электроотрицательность (ЭО)
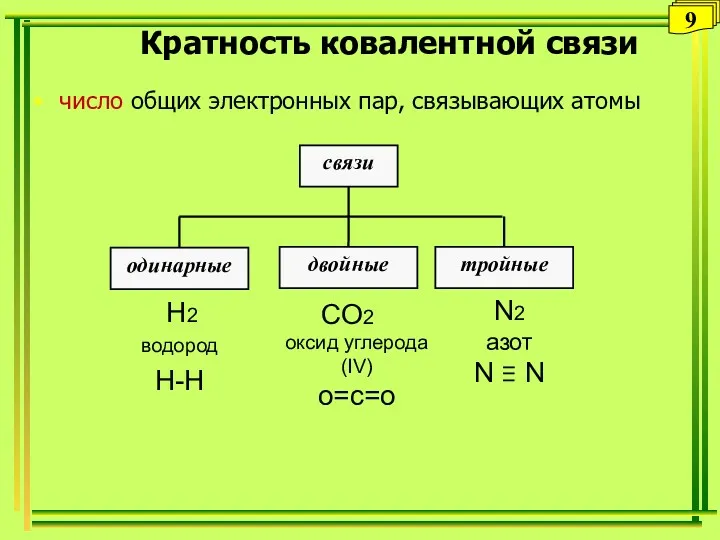
- 9. Кратность ковалентной связи число общих электронных пар, связывающих атомы 9
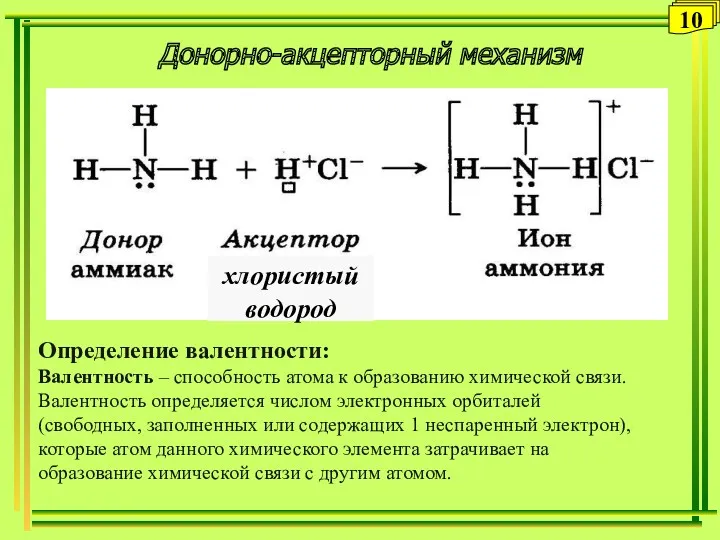
- 10. Донорно-акцепторный механизм 10 Определение валентности: Валентность – способность атома к образованию химической связи. Валентность определяется числом
- 11. Гибридизация атомных орбиталей Гибридизация – это выравнивание (усреднение) энергетических и геометрических характеристик атомных орбиталей разных подуровней
- 12. Примеры гибридизации (sp) 4Be: [He]2s2 4Be*: [He]2s12p1 s-АО + p-АО = 2sp-АО 12 4Be: 1s2 2s2
- 13. Примеры гибридизации (sp2) 5B: [He]2s22p1 5B*: [He]2s12p2 s-АО + 2p-АО = 3sp2-АО Плоский треугольник 13 5B:
- 14. Примеры гибридизации (sp3) 6С: [He]2s22p2 6С*: [He]2s12p3 s-АО + 3p-АО = 4sp3-АО Тетраэдр 14 6С: 1s2
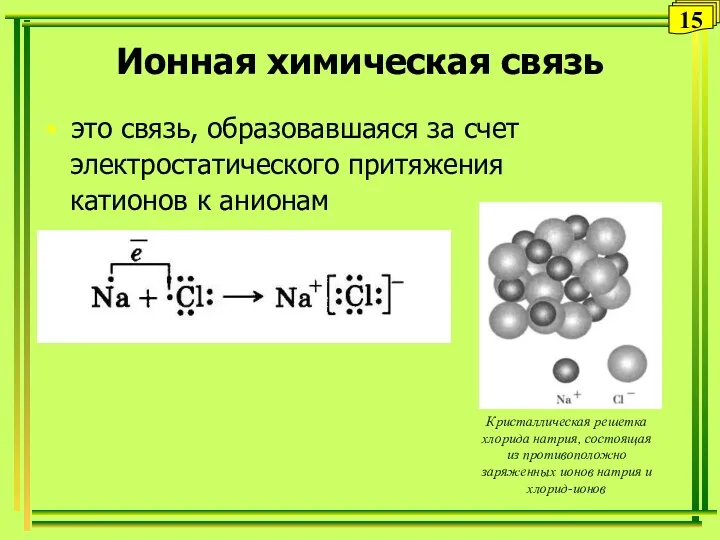
- 15. Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам 15 Кристаллическая решетка
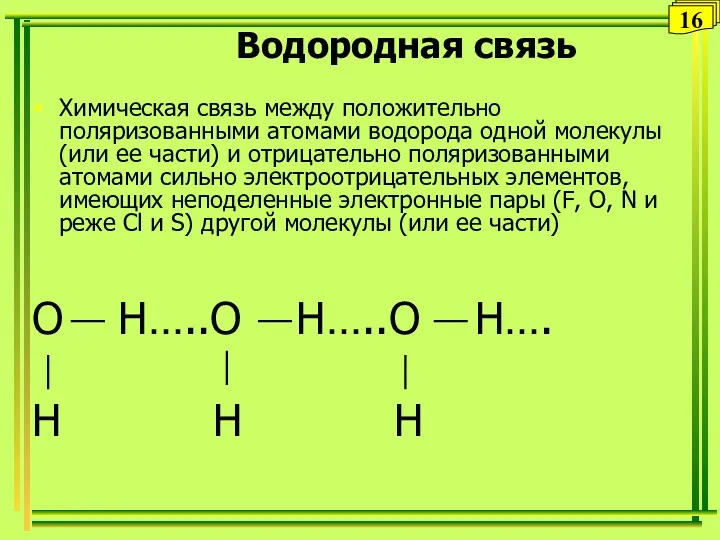
- 16. Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно
- 17. Металлическая связь связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в
- 18. Основные классы неорганических соединений Л-4
- 19. План лекции (ч.2) 1.Классификация неорганических веществ. 2. Оксиды, их классификация, получение, свойства. 3. Кислоты, их классификация,
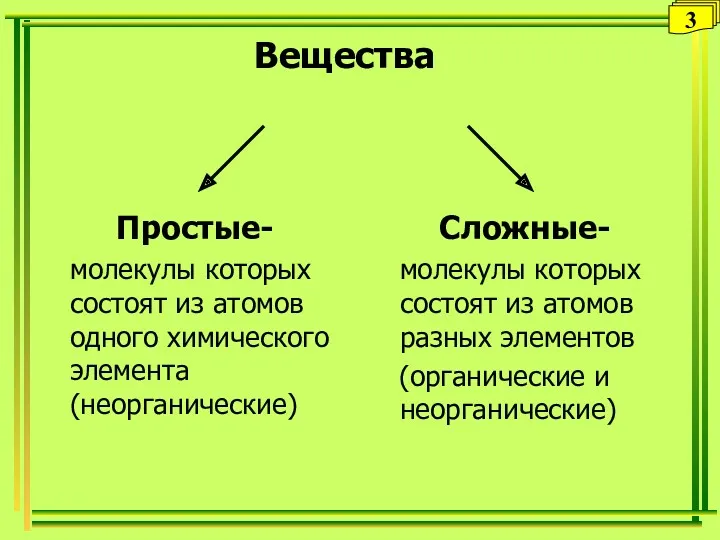
- 20. Вещества Простые- молекулы которых состоят из атомов одного химического элемента (неорганические) Сложные- молекулы которых состоят из
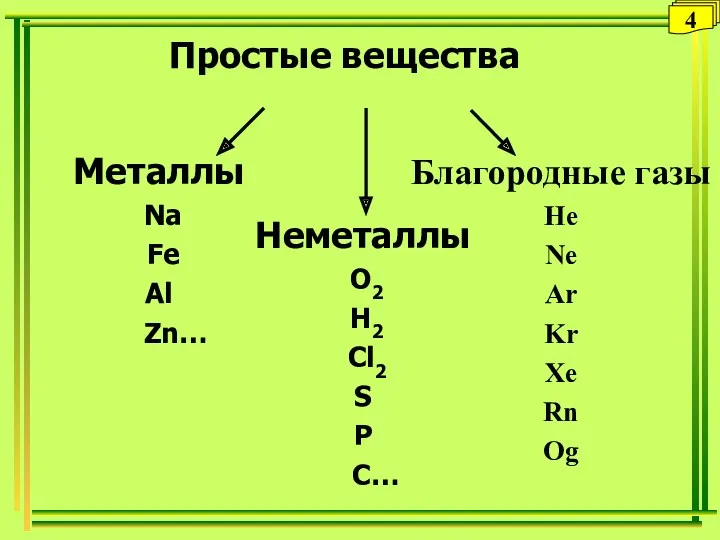
- 21. Благородные газы He Ne Ar Kr Xe Rn Оg Простые вещества Металлы Na Fe Al Zn…
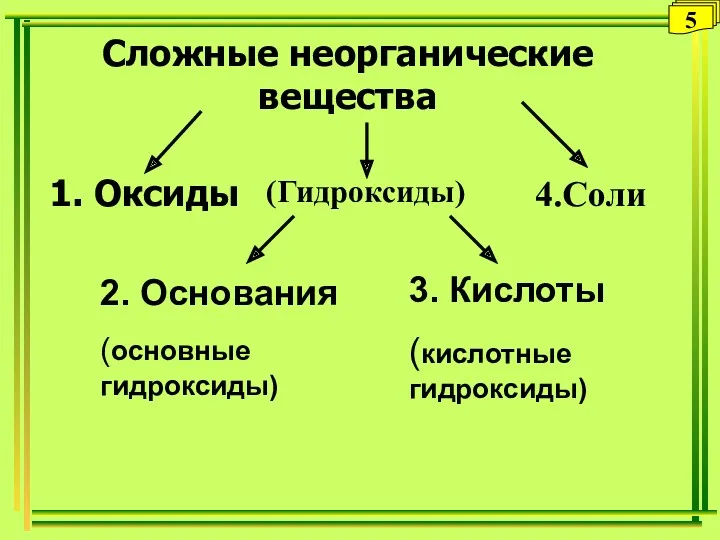
- 22. Сложные неорганические вещества 1. Оксиды (Гидроксиды) 4.Соли 2. Основания (основные гидроксиды) 3. Кислоты (кислотные гидроксиды) 5
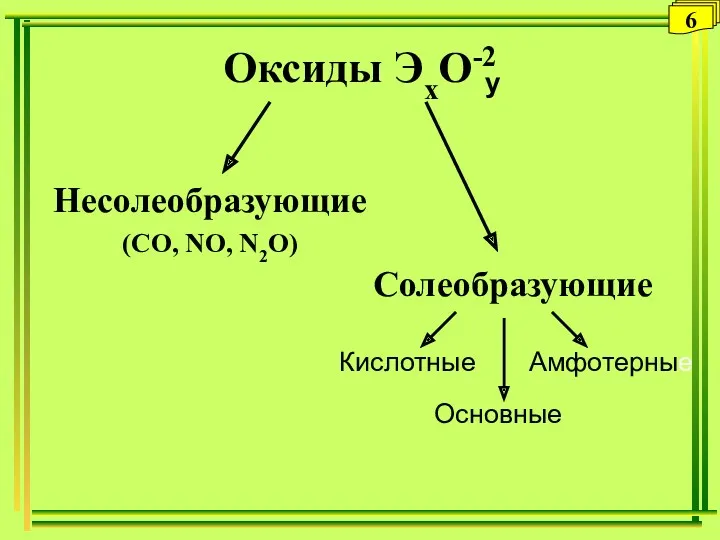
- 23. Несолеобразующие (СO, NO, N2O) Солеобразующие Кислотные Основные Амфотерные Оксиды ЭхО-2 y 6
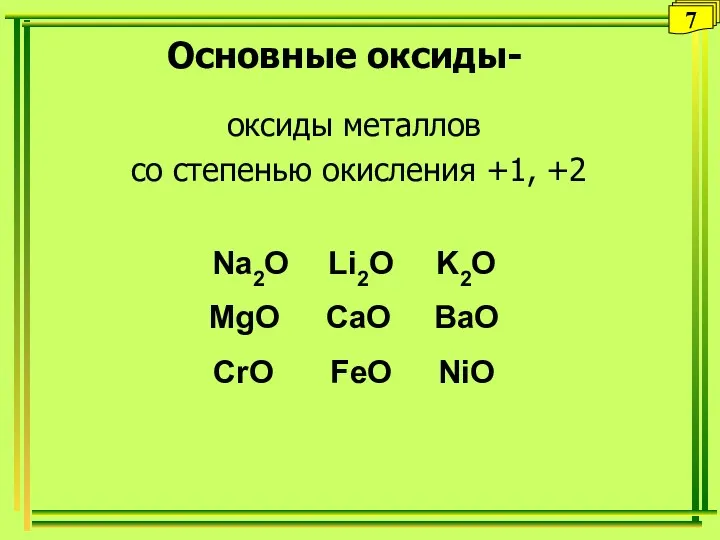
- 24. Основные оксиды- оксиды металлов со степенью окисления +1, +2 Na2O Li2O K2O MgO CaO BaO CrO
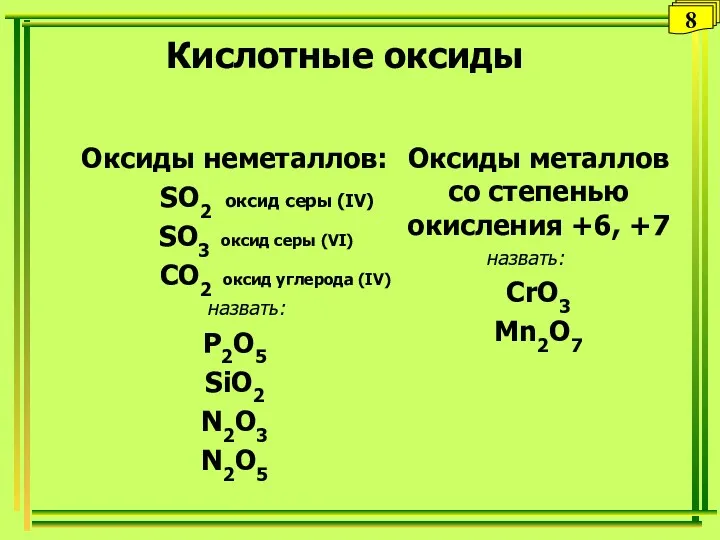
- 25. Кислотные оксиды Оксиды неметаллов: SO2 оксид серы (IV) SO3 оксид серы (VI) CO2 оксид углерода (IV)
- 26. Амфотерные оксиды ZnO Al2O3 Fe2O3 Cr2O3 CuO BeO PbO2 9
- 27. Способы получения оксидов 1. Взаимодействие простых веществ с кислородом: 4P + 5O2 = 2P2O5 2. Горение
- 28. 11
- 29. Основания Ме(ОН)x По растворимости в воде По силе Растворимые – щелочи Нерастворимые NaOH, KOH, Ba(OH)2 Fe(OH)3,
- 30. Соответствие оснований и оксидов Na2O – NaOH Li2O – LiOH K2O – KOH MgO – Mg(OH)2
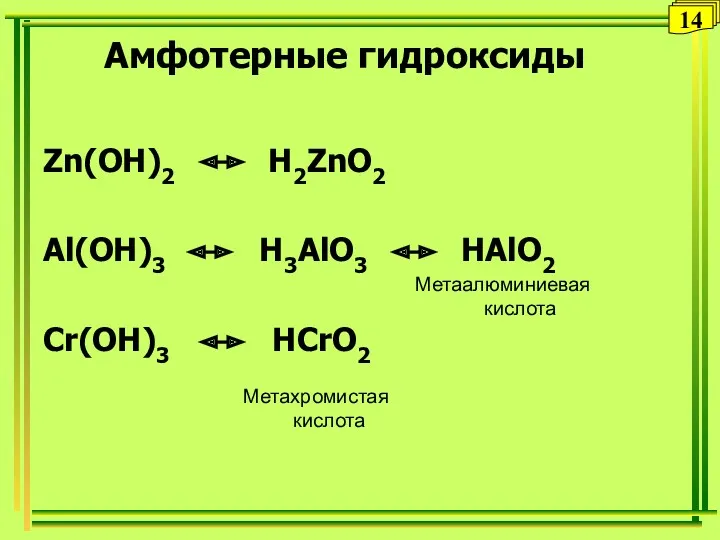
- 31. Амфотерные гидроксиды Zn(OH)2 H2ZnO2 Al(OH)3 H3AlO3 HAlO2 Cr(OH)3 HCrO2 Метаалюминиевая кислота Метахромистая кислота 14
- 32. Методы получения оснований 1. Взаимодействие щелочных и щелочноземельных металлов с водой: 2Li + 2H2O = 2LiOH
- 33. Химические свойства оснований 1. Реакции с кислотами (нейтрализация) и кислотными оксидами: Cu(OH)2 + H2SO4 = CuSO4
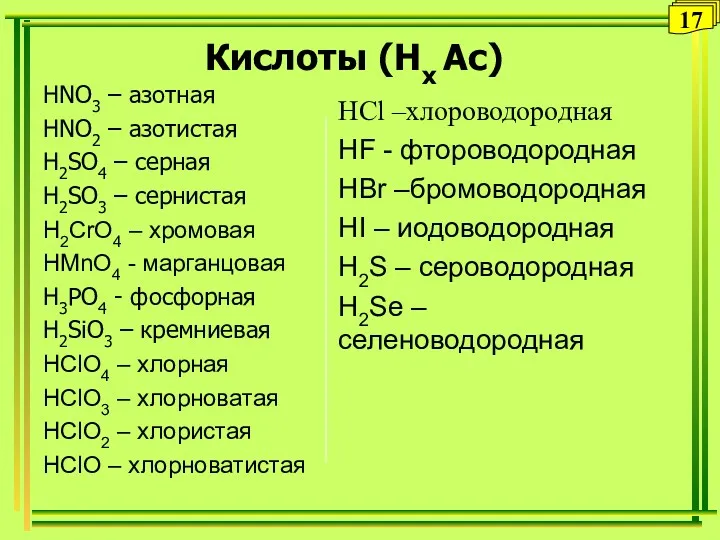
- 34. Кислоты (Нх Ас) HNO3 – азотная HNO2 – азотистая H2SO4 – серная H2SO3 – сернистая H2CrO4
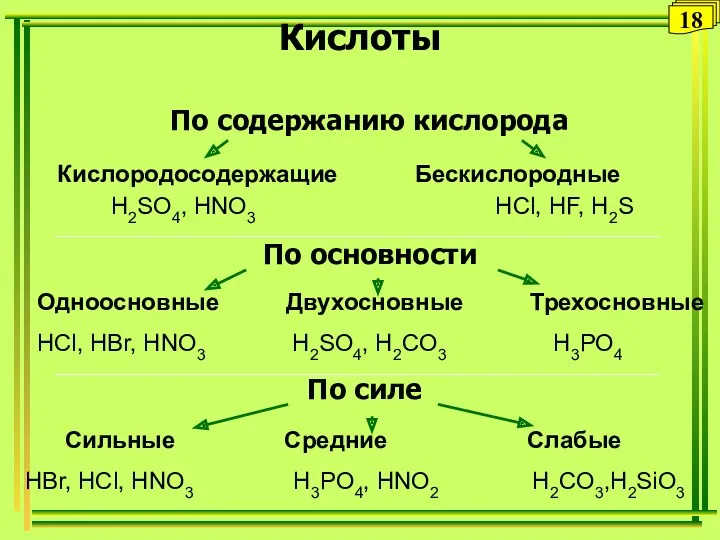
- 35. Кислоты По содержанию кислорода По основности По силе Кислородосодержащие Бескислородные H2SO4, HNO3 HCl, HF, H2S Одноосновные
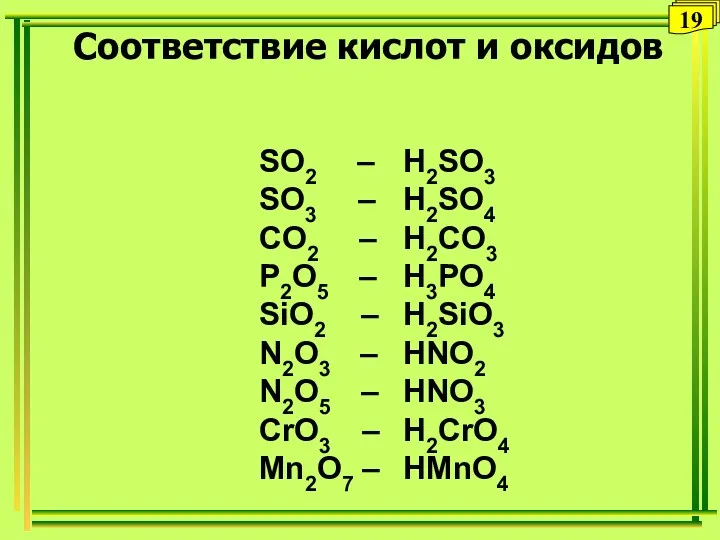
- 36. Соответствие кислот и оксидов SO2 – H2SO3 SO3 – H2SO4 CO2 – H2CO3 P2O5 – H3PO4
- 37. Методы получения кислот 1. Взаимодействие водорода с неметаллами, с последующим растворением галогенводорода в воде: H2 +
- 38. Общие химические свойства кислот Реакции обмена: HCl +NaOH = NaCl + H2O (с растворимым основанием) H2SO4
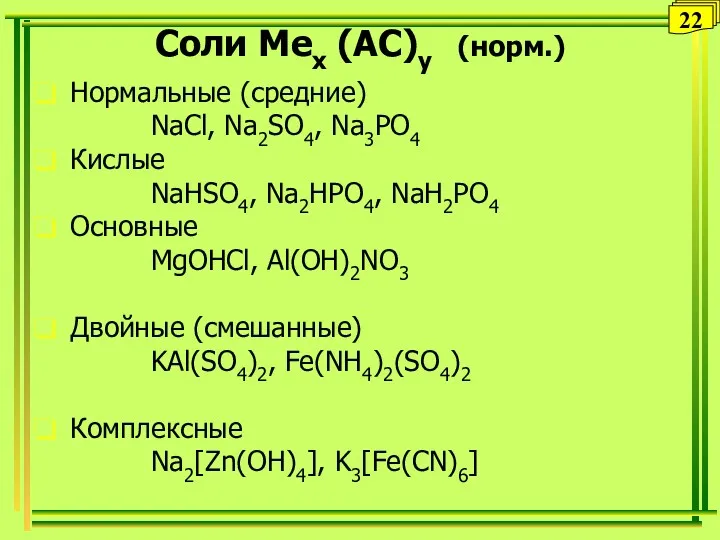
- 39. Соли Мex (AC)у (норм.) Нормальные (средние) NaCl, Na2SO4, Na3PO4 Кислые NaHSO4, Na2HPO4, NaH2PO4 Основные MgOHCl, Al(OH)2NO3
- 40. Методы получения солей 1. Взаимодействие металла с неметаллом:↑ 2Na + Cl2 = 2NaCl 2. Взаимодействие двух
- 41. Химические свойства солей 1. Взаимодействие c металлами: Zn+CuSO4=Cu+ZnSO4 2. Взаимодействие cо щелочами СuSO4 + 2KOH =
- 42. Генетическая связь между классами неорганических соединений Элемент – Оксид – – Основание (кислота) – Соль Fe
- 43. Литература Кафедра химии УрГАУ/ ВКонтакте Vk.com/club86527277 Тел кафедры: 221-41-03 1. О.С. Габриелян и др. Химия. Учебное
- 44. 33 Вопросы к экзамену по общей и неорганической химии 1. Понятия: материя, вещество. Предмет науки химия
- 45. 34 Вопросы к экзамену (продолжение) 9. Основные законы химии: закон сохранения массы вещества, закон постоянства состава
- 47. Скачать презентацию




![Примеры гибридизации (sp) 4Be: [He]2s2 4Be*: [He]2s12p1 s-АО + p-АО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/295559/slide-11.jpg)
![Примеры гибридизации (sp2) 5B: [He]2s22p1 5B*: [He]2s12p2 s-АО + 2p-АО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/295559/slide-12.jpg)
![Примеры гибридизации (sp3) 6С: [He]2s22p2 6С*: [He]2s12p3 s-АО + 3p-АО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/295559/slide-13.jpg)


















 20230419_azot
20230419_azot Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Философы химии Кант и Гегель
Философы химии Кант и Гегель Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Пластмассы
Пластмассы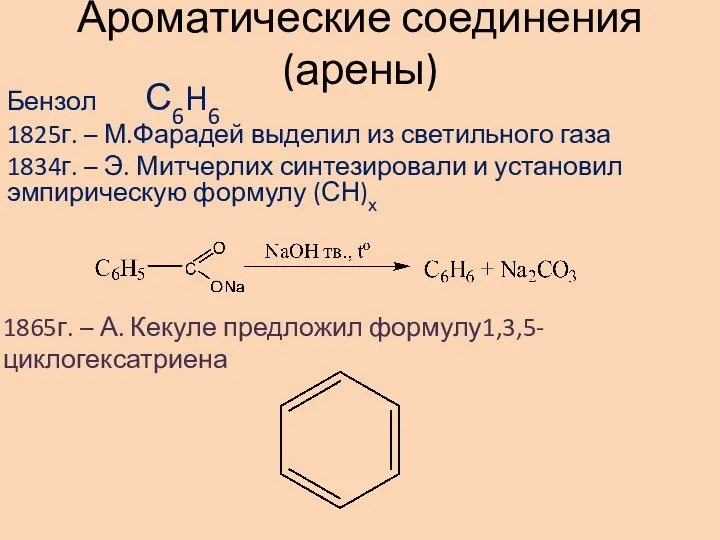 Ароматические соединения (арены)
Ароматические соединения (арены) Алюминий, его амфотерные свойства
Алюминий, его амфотерные свойства №9 зертханалық жұмыс
№9 зертханалық жұмыс Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Общая характеристика неметаллов
Общая характеристика неметаллов Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Алмазы. Бриллианты
Алмазы. Бриллианты Аммиак: состав вещества, получение, применение, строение, свойства
Аммиак: состав вещества, получение, применение, строение, свойства Твердотільний ямр
Твердотільний ямр Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Металлы II группы побочной подгруппы таблицы Д.И. Менделеева
Металлы II группы побочной подгруппы таблицы Д.И. Менделеева Карбоновые кислоты. Уксусная кислота
Карбоновые кислоты. Уксусная кислота История мыловарения
История мыловарения Виды мелиорации земель. Химическая реабилитация урбаноземов
Виды мелиорации земель. Химическая реабилитация урбаноземов Основные понятия и законы химии
Основные понятия и законы химии Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет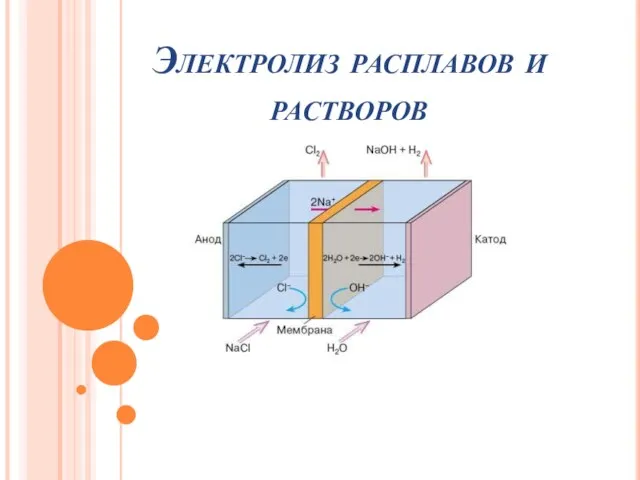 Электролиз расплавов и растворов
Электролиз расплавов и растворов Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Биоорганическая химия
Биоорганическая химия