Содержание
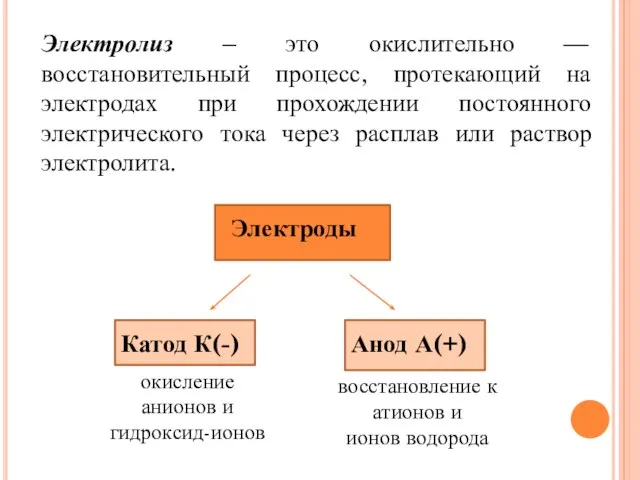
- 2. Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через
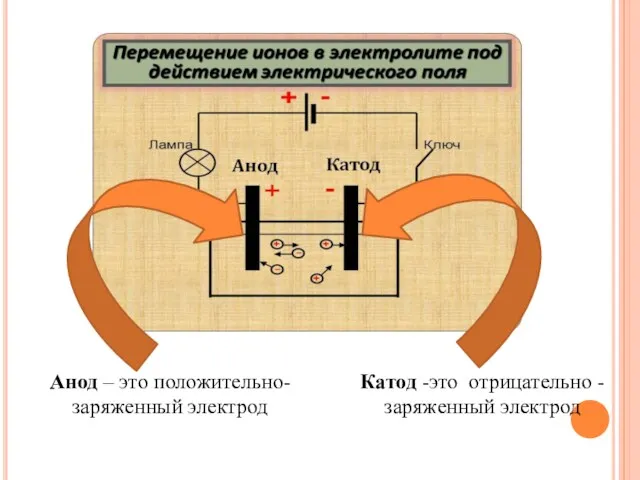
- 3. Катод -это отрицательно - заряженный электрод Анод – это положительно- заряженный электрод
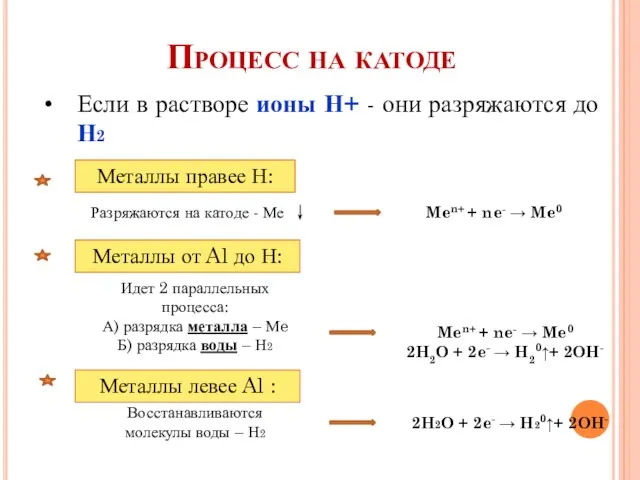
- 4. Процесс на катоде Если в растворе ионы Н+ - они разряжаются до Н2 Металлы правее Н:
- 5. Процесс на аноде если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в
- 6. Анионы бескислородных кислот (кроме F-) Разряжаются до простого вещества: S2-, I-, Br-, СI- Анионы кислородсодержащих кислот
- 7. Анионы карбоновых кислот – реакция Кольбе Происходит процесс декарбоксилирования и выделяется алкан 2СН3СОО- - 2е- →
- 8. 1. Анод нерастворимый (например, графитовый) Суммарное уравнение: Учитывая присутствие ионов Na в растворе: Пример №1.
- 9. Суммарное ионное уравнение: Суммарное молекулярное уравнение: Пример №2.
- 10. 2. Анод растворимый (например, медный) Если анод растворимый, то металл анода будет окисляться: Катионы Cu2+ в
- 11. Проверь себя… Задания на электролиз
- 12. При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1) хлор 2)
- 13. При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1) хлор 2)
- 14. Задание 3 Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного
- 15. Задание 4 Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного
- 16. Задание 5 Установите соответствие между веществом и продуктами его электролиза в растворе или расплаве: к каждой
- 17. Задание 6 Вычислите объём в литрах газа, выделяющегося на аноде при электролизе водного раствора гидроксида кальция
- 18. Задание 7 Какая масса (в граммах) гидроксида лития образуется в растворе при электролизе водного раствора хлорида
- 20. Скачать презентацию














 Типы химических реакций
Типы химических реакций Закон сохранения массы веществ
Закон сохранения массы веществ Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Кристаллические решетки
Кристаллические решетки Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Моющие средства
Моющие средства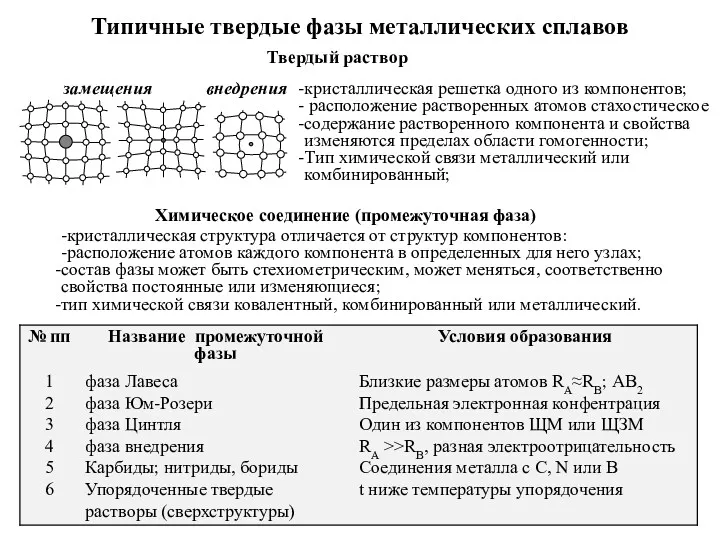 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Гигиена питания школьников
Гигиена питания школьников Классификация химических реакций
Классификация химических реакций Геохимия литосферы
Геохимия литосферы Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Гидролиз солей
Гидролиз солей Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Роль химии в создании новых материалов
Роль химии в создании новых материалов