Слайд 2

АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Хімічний диктант
Записати рівняння реакцій, вказати їх типи.
1 варіант 2 варіант
1.
SO3 + H2O? 1. SO2 + H2O ?
2. Fe + HCl ? 2. Al + HCl?
3. N2O5 + H2O? 3. P2O5 + H2O?
4. CaO + HCl? 4. MgO + HCl?
5. FeO + H2SO4? 5. CaO + H2O?
6. Cu + H2SO4? 6. Na2O + H2SO4?
7. CO2 + H2O? 7. Hg + H2SO4?
8. KOH + H2SO4? 8. Cu(OH)2 + HCl?
9. Fe(OH)3? 9. H2CO3?
10. Fe + CuSO4? 10. Zn + HgCl2?
Слайд 3

ОКИСНО-ВІДНОВНІ РЕАКЦІЇ, ЇХ ЗНАЧЕННЯ
На сьогоднішньому уроці перед вами стоять завдання:
з’ясувати роль
окисно-відновних реакцій у природі, техніці, житті людини;
удосконалити вміння визначати ступені окиснення, записувати схеми процесів окиснення та відновлення, підбирати коефіцієнти методом електронного балансу.
Слайд 4

Запишемо рівняння реакції
Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu0
Слайд 5
Слайд 6

Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu0
Відновник Fe0 -
2e = Fe+2
Окисник Cu+2 + 2e = Cu0
Слайд 7

Основні поняття
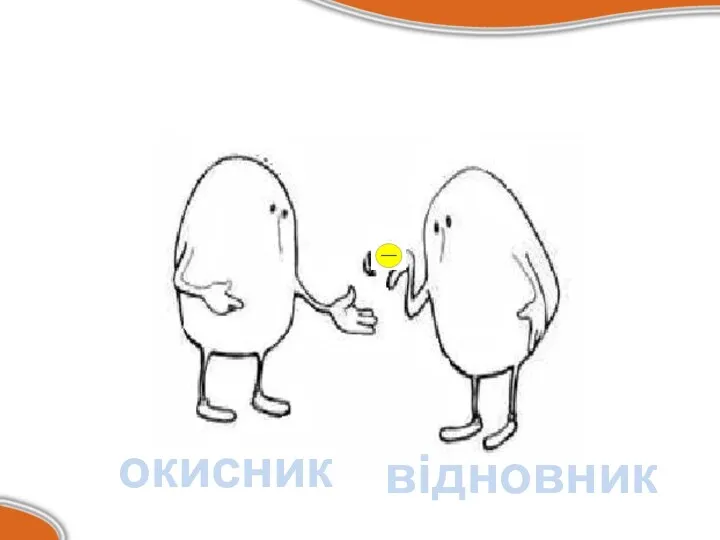
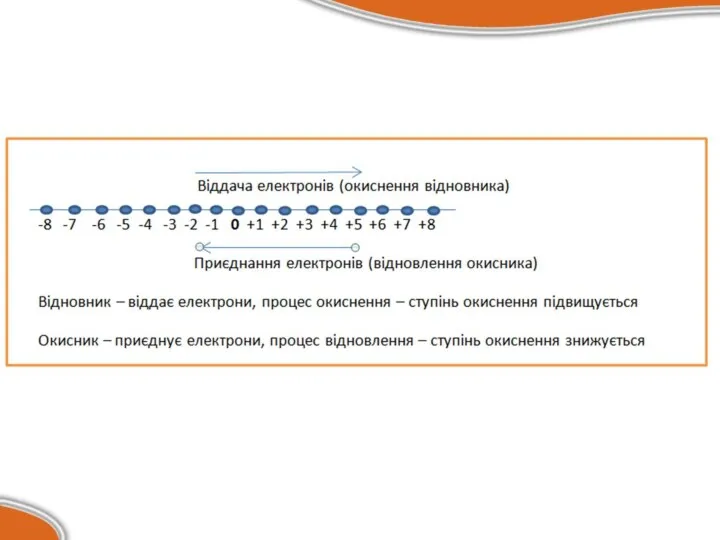
Окиснення — це процес віддачі електрона.
Відновлення — процес прийому
електрона.
Атом, що віддає електрони, називається відновником.
Атом, що приймає електрони, називається окисником.
Слайд 8
Слайд 9

АЛГОРИТМ СКЛАДАННЯ ЕЛЕКТРОННОГО БАЛАНСУ
Визначити, які елементи в процесі хімічної реакції
змінюють ступінь окиснення.
Записати окремо процеси окиснення та відновлення з указівкою кількості електронів, що беруть участь у кожнім процесі.
У записаному рівнянні реакції визначити ступені окиснення всіх елементів.
Визначити окисник і відновник.
Визначити коефіцієнти, на які необхідно помножити рівняння окиснення й відновлення, щоб кількість електронів, відданих відновником і прийнятих окисником, була однаковою.
Просумувати рівняння окиснення й відновлення з урахуванням отриманих коефіцієнтів або розставити відповідні коефіцієнти у вихідному рівнянні.
Слайд 10

Оформлення окисно-відновної реакції з електронним балансом
Слайд 11

Окисно-відновні реакції в природі та житті людини:
- процеси дихання у тварин
-
процес фотосинтезу у рослин
- процес дихання у людини
- металургія
- електроніка
- електротехніка
- енергетика
- косметологія
Слайд 12

УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
3і списку рівнянь реакцій учні повинні вибрати
окисно-відновні та скласти електронний баланс.
1 варіант:
KBr + Сl2 → КСl + Вr2;
Zn + HCl → ZnCl2 + H2;
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O;
Al + S → Al2S3;
NaOH + P2O5 → Na3PO4 + H2O;
Слайд 13

УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
3і списку рівнянь реакцій учні повинні вибрати окисно-відновні
та скласти електронний баланс.
2 варіант:
Fe + Cl2 → FeCl3;
NaOH + HCl → NaCl + H2O;
KClO3 + P → KCl + P2O5;
CaO + CO2 → CaCO3;
KCl + F2 → KF + Cl2;
Слайд 14

Перевірка
1 варіант:
2KBr + Сl2 → 2 КСl + Вr2;
Cl20+ 2е
→ 2Cl- 2 1
2Br- - 2е → Br20 2 1
Zn + 2HCl → ZnCl2 + H2;
2Cl- - 2е → Cl20 2 1
2H+ +2е→ H20 2 1
2Al + 3S → Al2S3;
Al0 – 3е → Al+3 3 2
S0 +2е → S-2 2 3
Слайд 15

2 варіант:
2Fe + 3Cl2 → 2 FeCl3;
Fe0 – 3е →Fe+3 3
2
Cl20+ 2е → 2Cl- 2 3
5KClO3 + 6P → 5KCl + 3P2O5;
P0 – 5е → P+5 5 6
Cl+5+ 6е→Cl- 6 5
2KCl + F2 → 2KF + Cl2;
2Cl- - 2е → Cl20 2 1
F20 + 2е → 2F- 2 1














 Синтетический каучук и его применение
Синтетический каучук и его применение Трансмиссионные масла
Трансмиссионные масла 20230816_belki_2
20230816_belki_2 Геохимия урана и тория в магматическом процессе
Геохимия урана и тория в магматическом процессе Вуглеводи
Вуглеводи Ртуть
Ртуть Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Химия нефти и газа
Химия нефти и газа Indicatori di pH
Indicatori di pH Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Серная кислота
Серная кислота Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Метал конструкциялық материалдар
Метал конструкциялық материалдар Місце хімії серед наук про природу
Місце хімії серед наук про природу Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Химия элементов VIIA группы
Химия элементов VIIA группы Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Классы органических соединений
Классы органических соединений Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Состав и классификация магматических горных пород
Состав и классификация магматических горных пород Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения?