Содержание
- 2. Что читать? Ахметов Н.С. «Общая и неорганическая химия». Карапетьянц М.Х., Дракин С.И. «Общая и неорганическая химия».
- 3. S2Р5 S1 + электрон Полностью заполненный уровень Стабильный ион Н- Двухатомная молекула, как и других галогенов:
- 4. Сравним водород с элементами первой и седьмой группы H+ + e = 1/2H2 E°=0 Li+ +
- 5. Распространение водорода ат.% Во вселенной H – 88.6% He – 11.3% Остальное – 0,1% На Земле
- 6. Степени окисления водорода 1S1 + электрон - электрон -1 +1 0 ПРИМЕРЫ NaH LiAlH4 H2 H2O
- 7. Протонные кислоты и основания (по Брэнстэду) H2O + H2O = H3O+ + OH- H2S = H+
- 8. Получение водорода Лабораторные способы: Основаны на ОВР 1. CaH2 + 2 H2O = Ca(OH)2 + H2
- 9. Промышленные способы получения водорода 750 °C Ni CH4 + H2O → CO + 3H2 C(кокс) +
- 10. Использование водорода H2 NH3 - аммиак Маргарин Органические реактивы Металлургия Mo, W
- 11. Водородная энергетика Водородная энергетика — направление выработки и потребления энергии человечеством, основанное на использовании водорода в
- 12. Галогены αλς – морская соль γεν – рождать Солероды F, Cl, Br, I, At nS2nP5
- 13. Распространение в природе F Cl Br I At 0.063 0.017 0.0002 4.10-5 - 13 место 20
- 14. Происхождение названий элементов и первооткрыватели F Cl Br I At Разрушительный Текучий Желто-зеленый Зловонный Фиолетовый Неустойчивый
- 15. F Cl Br I At Физические свойства Температуры кипения и плавления (°С) -220 -101 -7 117
- 16. Получение F2 Только электролиз!!! KF tпл= 846 °С HF плохой проводник KHF2 tпл= 239 °С KF•4HF
- 17. Абу Али Хусейн ибн Абдаллах ибн Си́на «Авиценна» «Все есть яд, все есть лекарство – всему
- 18. Получение Cl2 Все тот же электролиз. Промышленный способ. Электролиз водных растворов: 2 H2O + 2 NaCl
- 19. Получение Br2 I2 Электролиз. Промышленный способ. Окисление галогенид-ионов 2KMnO4 + 16HBr → 5Br2 + 2MnBr2 +
- 20. Получение галогеноводородов Реакция замещения CaF2 + H2SO4 → 2HF + CaSO4 2NaCl + H2SO4 → 2HCl
- 21. Галогеноводороды При с.у. безцветные газы, хорошо растворимые в воде. Растворы в воде – сильные кислоты (кроме
- 22. Взаимодействие галогенов с водой Фтор – уникальный окислитель, очень сильный: 2F2 + 2H2O = 4HF +
- 23. Химические свойства nS2nP5 +7 +5 +3 +1 0 -1 Степени окисления ОК И С ЛИ Т
- 25. Скачать презентацию






















 Месторождения берилла и топаза
Месторождения берилла и топаза Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Соединения железа
Соединения железа Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Методика преподавания химии
Методика преподавания химии Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Электронные конфигурации атомов
Электронные конфигурации атомов Метод молекулярных орбиталей
Метод молекулярных орбиталей Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы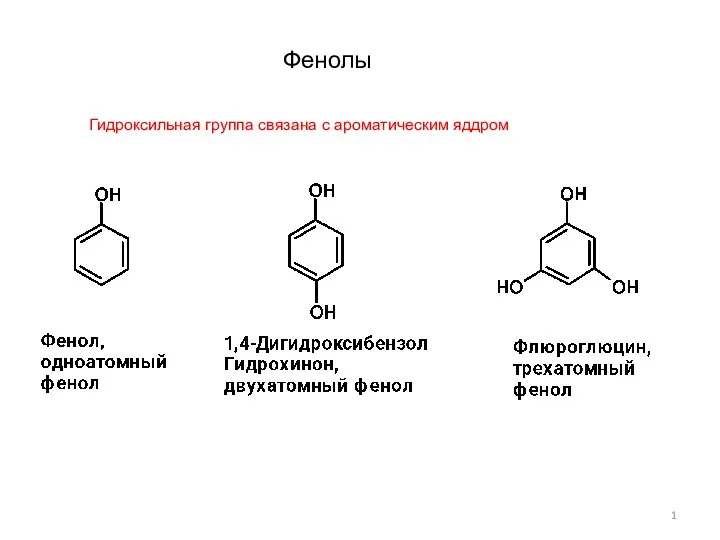 Фенолы-1
Фенолы-1 Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Сложные эфиры
Сложные эфиры Основні класи неорганічних сполук
Основні класи неорганічних сполук Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Производство полимеров
Производство полимеров Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы Гетероциклические соединения
Гетероциклические соединения Свойства воды. Оценка качества
Свойства воды. Оценка качества Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Solutions and solubilities
Solutions and solubilities Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ