Содержание
- 2. Способы получения Гидролиз ароматических галогенпроизводных (промышленный способ) Неактивированное замещение-ариновый механизм Активированное замещение, SNAr
- 3. Получение фенола из гидроперекиси изо-пропилбензола (промышленный способ) Замещение сульфонатной группы, щелочной плав сульфонатов (промышленный способ, старейший
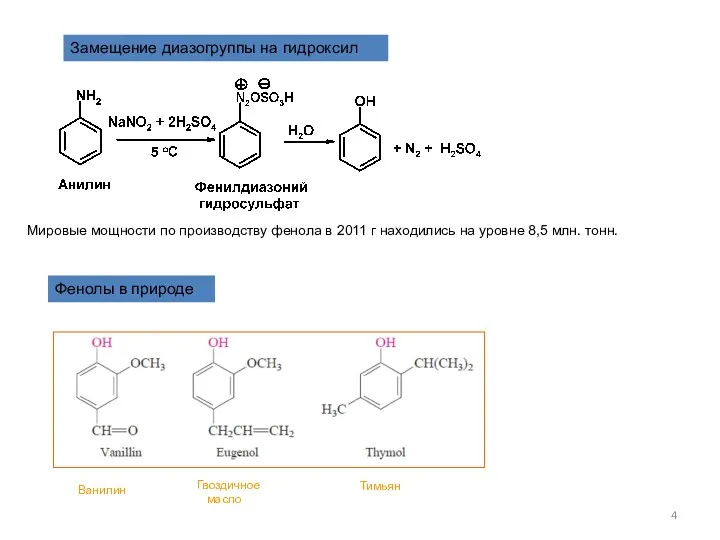
- 4. Замещение диазогруппы на гидроксил Мировые мощности по производству фенола в 2011 г находились на уровне 8,5
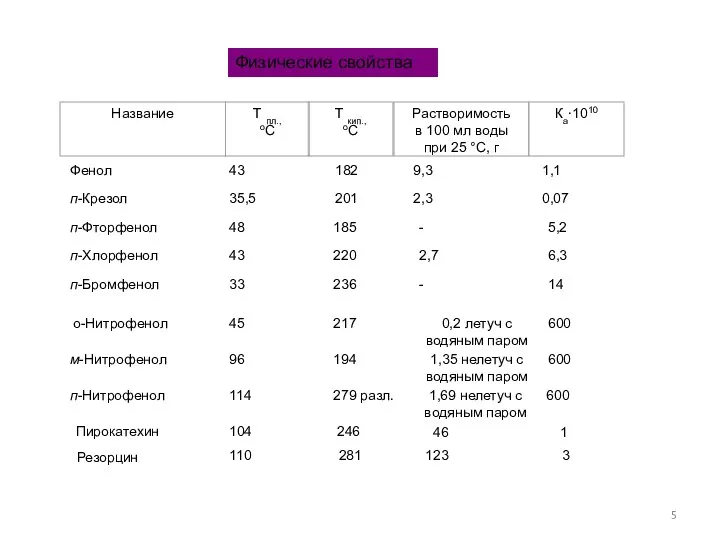
- 5. Физические свойства
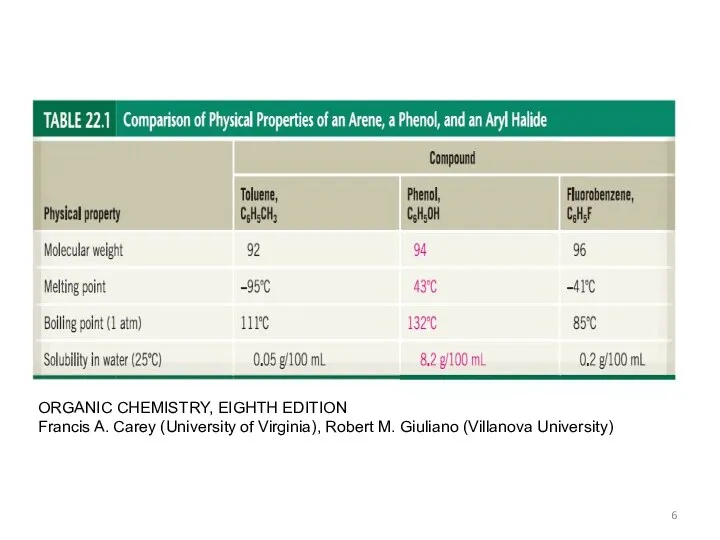
- 6. ORGANIC CHEMISTRY, EIGHTH EDITION Francis A. Carey (University of Virginia), Robert M. Giuliano (Villanova University)
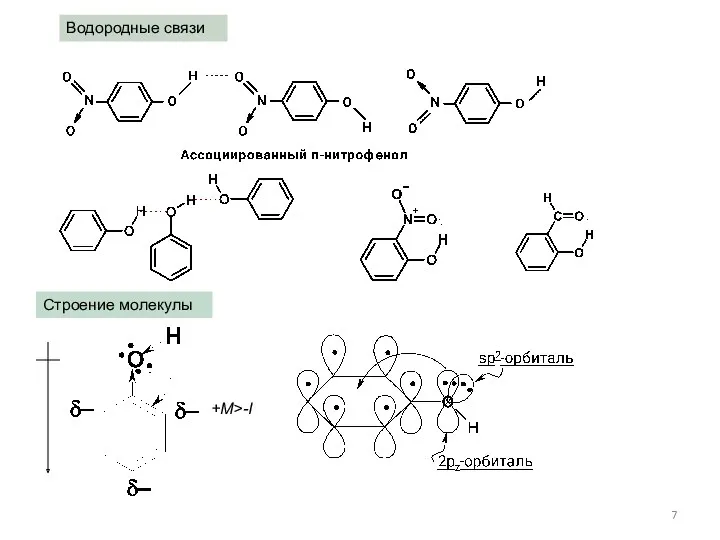
- 7. Строение молекулы +M>-I Водородные связи
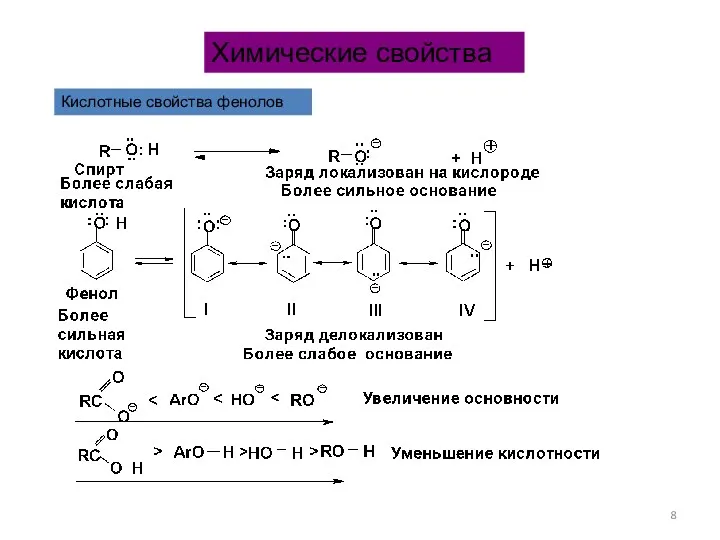
- 8. Кислотные свойства фенолов Химические свойства
- 9. Образование солей Относительно высокая кислотность фенолов определяется: p-π-сопряжением n-электронов кислорода и π-электронов ароматического ядра. Заряд делокализуется.
- 10. ORGANIC CHEMISTRY, EIGHTH EDITION Francis A. Carey (University of Virginia), Robert M. Giuliano (Villanova University) Стабилизация
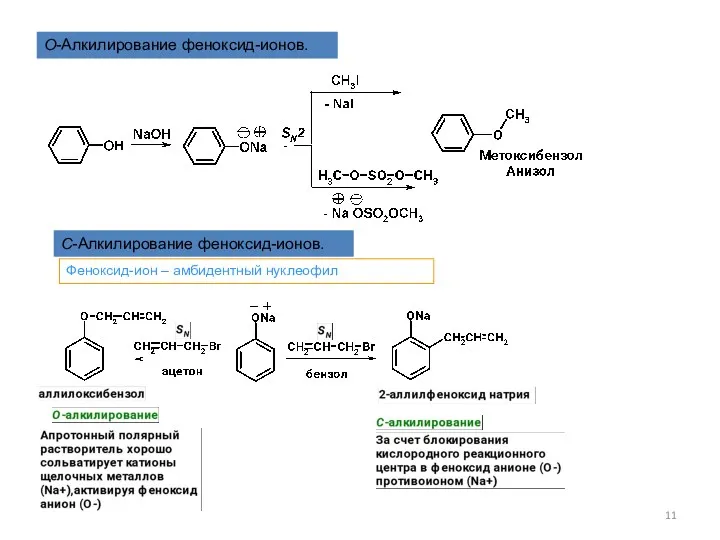
- 11. O-Алкилирование феноксид-ионов. С-Алкилирование феноксид-ионов. Феноксид-ион – амбидентный нуклеофил
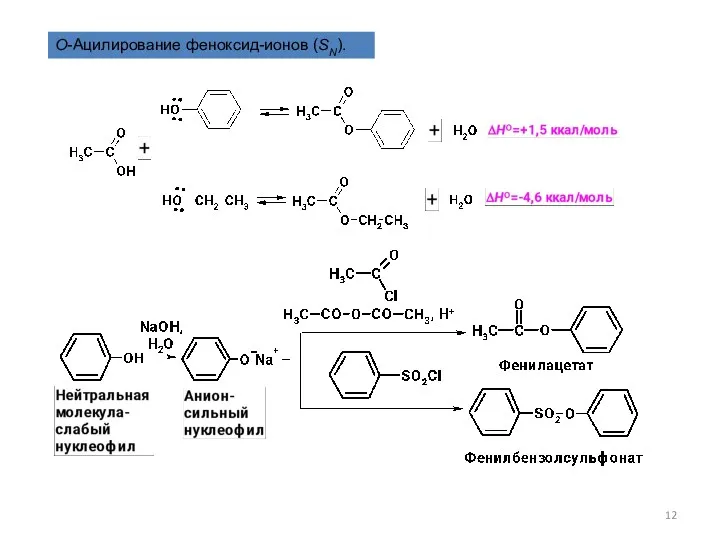
- 12. O-Ацилирование феноксид-ионов (SN).
- 13. Перегруппировка Фриса Схема реакции
- 14. Пергруппировка Кляйзена Пример сигматропной перегруппировки – перемещение σ-связи
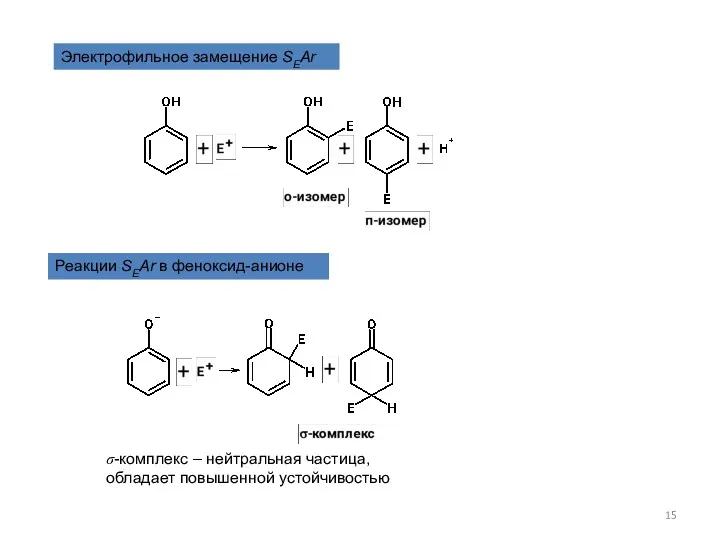
- 15. Электрофильное замещение SEAr Реакции SEAr в феноксид-анионе σ-комплекс – нейтральная частица, обладает повышенной устойчивостью
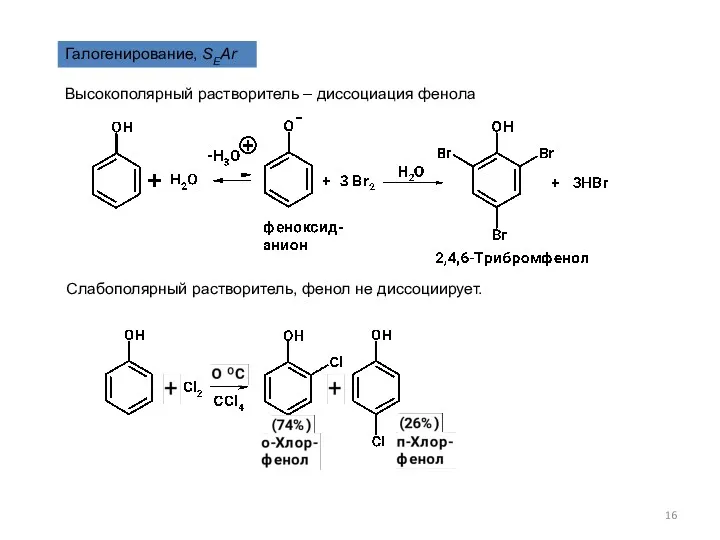
- 16. Галогенирование, SEAr Высокополярный растворитель – диссоциация фенола Слабополярный растворитель, фенол не диссоциирует.
- 17. Механизм бромирования феноксид-иона Галогенирование фенола в присутствии сильной кислоты Полностью подавлена диссоциация фенола
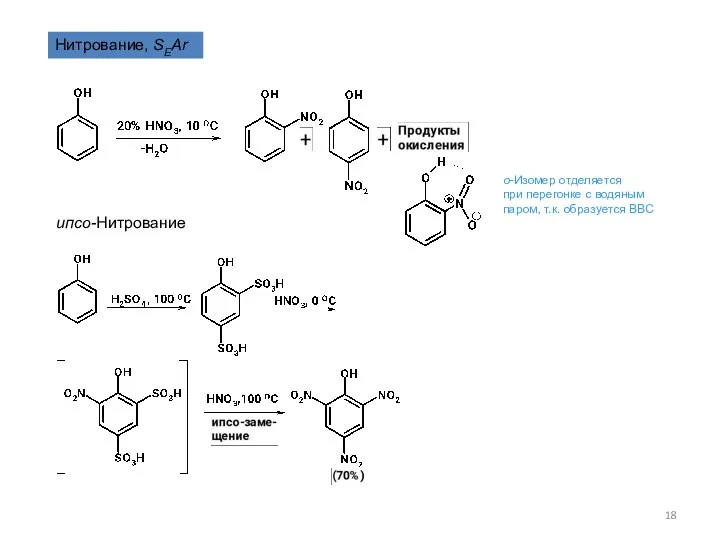
- 18. Нитрование, SEAr ипсо-Нитрование о-Изомер отделяется при перегонке с водяным паром, т.к. образуется ВВС
- 19. Сульфирование, SEAr Кинетический контроль Термодинамический контроль
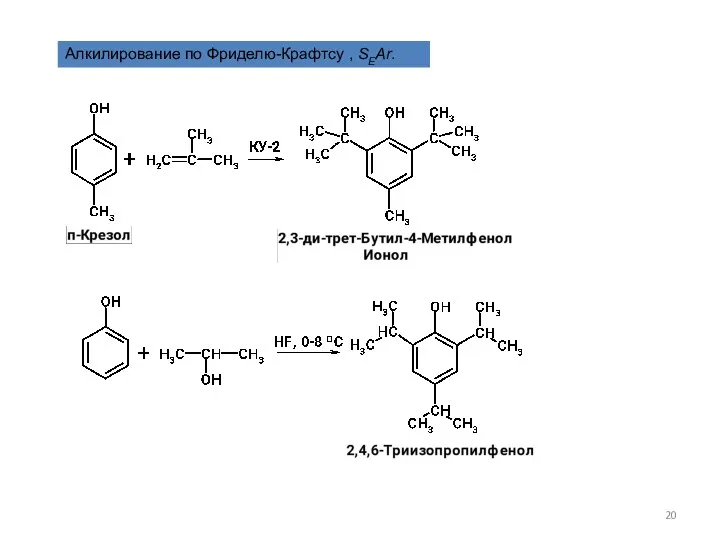
- 20. Алкилирование по Фриделю-Крафтсу , SEAr.
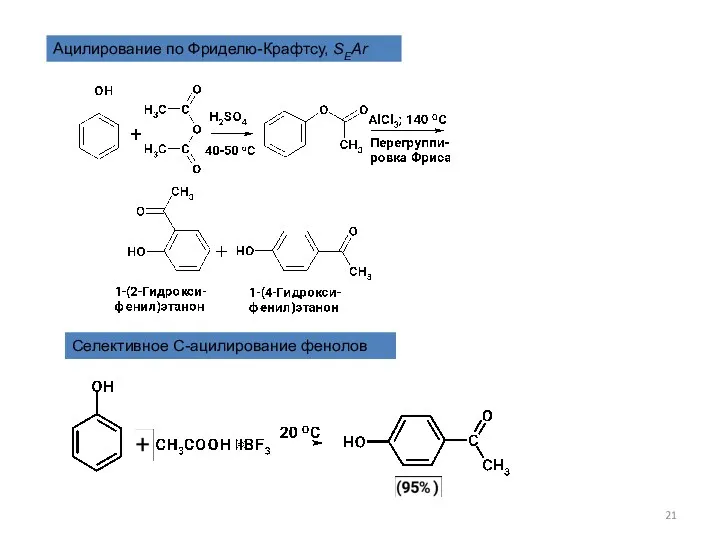
- 21. Ацилирование по Фриделю-Крафтсу, SEAr Селективное С-ацилирование фенолов
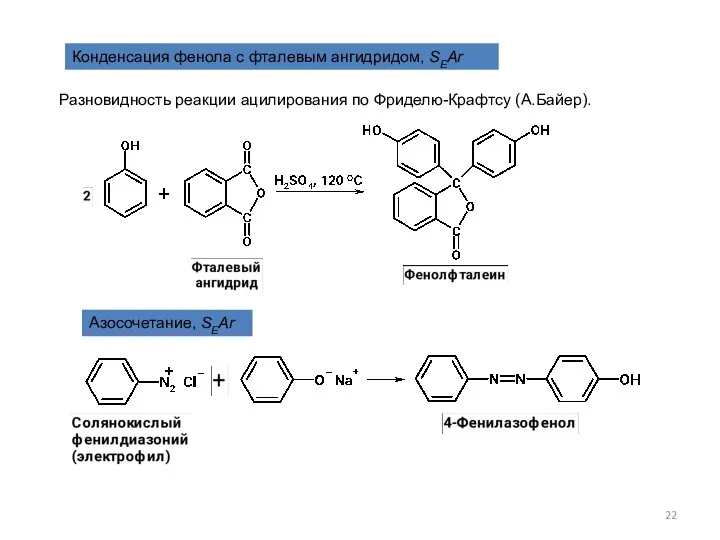
- 22. Конденсация фенола с фталевым ангидридом, SEAr Разновидность реакции ацилирования по Фриделю-Крафтсу (А.Байер). Азосочетание, SEAr
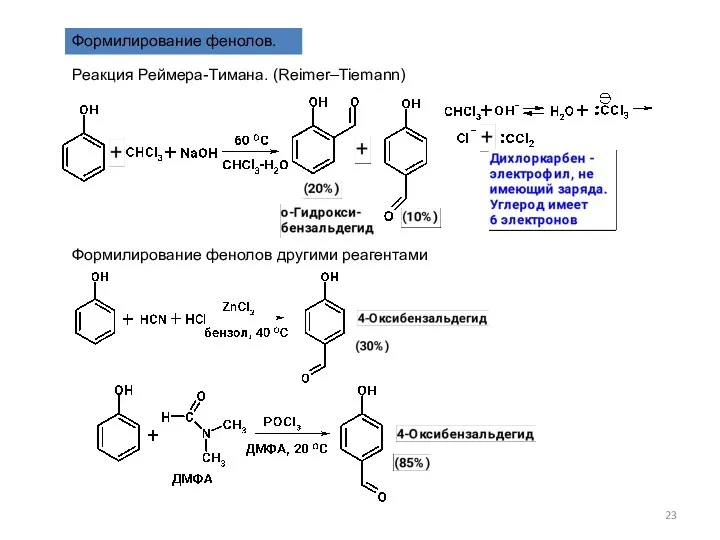
- 23. Формилирование фенолов. Реакция Реймера-Тимана. (Reimer–Tiemann) Формилирование фенолов другими реагентами
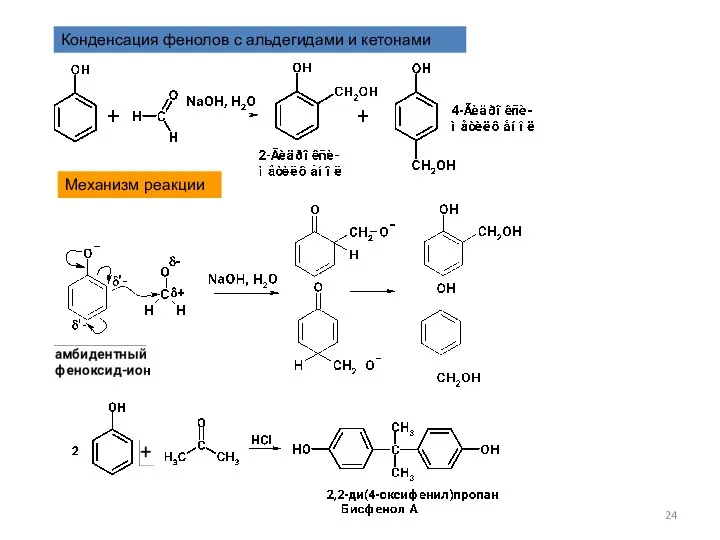
- 24. Конденсация фенолов с альдегидами и кетонами Механизм реакции
- 25. Фенол-формальдегидная смола (Л.Бакелунд, 1909 г.). Первое синтетическое высокомолекулярное вещество. Бакелит
- 26. Карбоксилирование феноксид-ионов. Реакция Кольбе-Шмидта. Окисление. Восстановление
- 28. Скачать презентацию










 Сравнительная характеристика галогенов
Сравнительная характеристика галогенов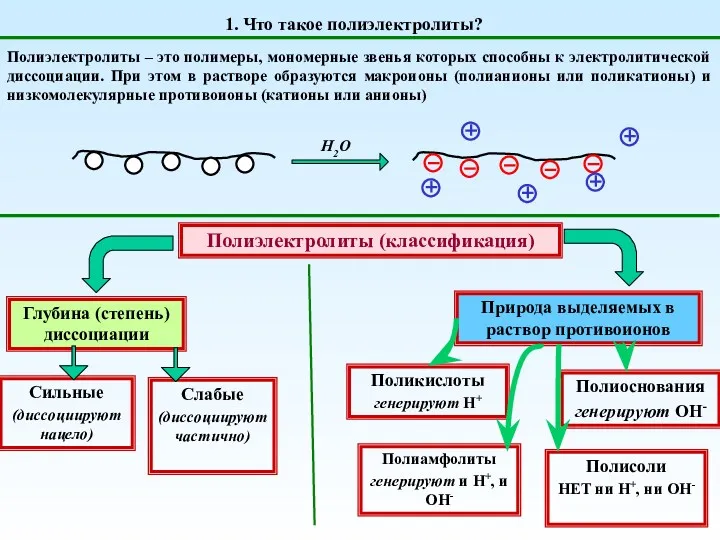 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов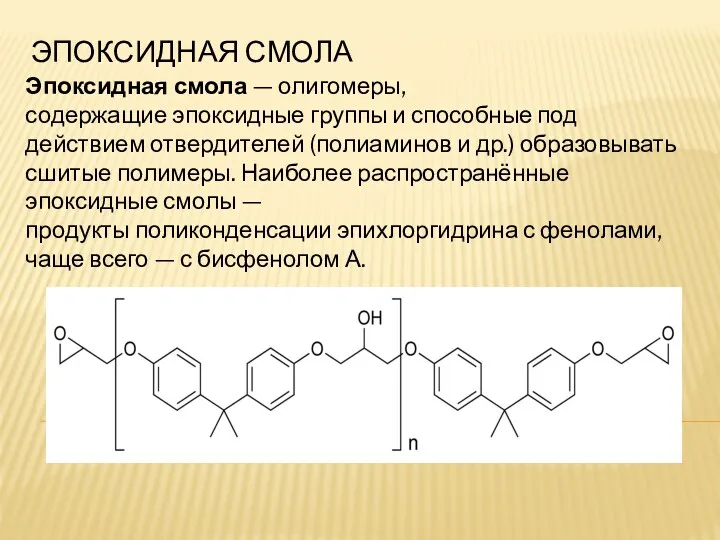 Эпоксидная смола
Эпоксидная смола Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины Щёлочноземельные металлы
Щёлочноземельные металлы Спирты. Определение. Классификация
Спирты. Определение. Классификация Кислотно-основное титрование
Кислотно-основное титрование Химический элемент и вещество
Химический элемент и вещество Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Фосфор и его соединения
Фосфор и его соединения Алюминий на кухне - опасный враг или верный помощник?
Алюминий на кухне - опасный враг или верный помощник?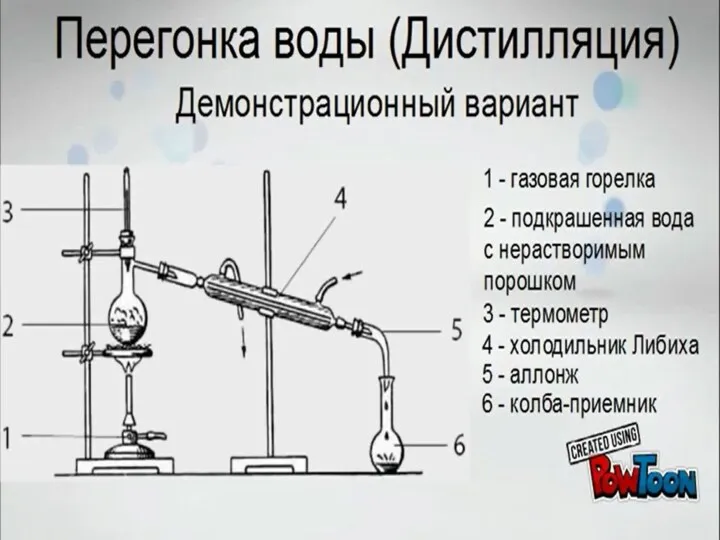 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Атом - сложная частица
Атом - сложная частица Горные породы
Горные породы Алкины. Ацетилен.
Алкины. Ацетилен. Спектрофометрия
Спектрофометрия Воздух, которым мы дышим
Воздух, которым мы дышим Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Щелочные металлы
Щелочные металлы Качественные реакции
Качественные реакции Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ