Содержание
- 2. Цель: расширить представление об элементах-аналогах Периодической системы на примере подгруппы галогенов Задачи: Познакомить учащихся с историей
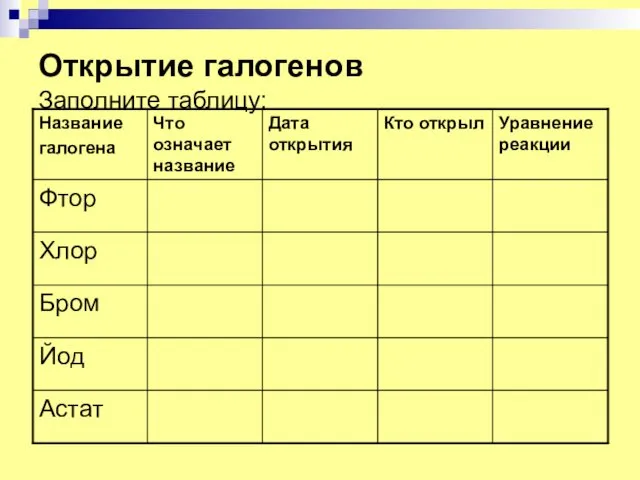
- 3. Открытие галогенов Заполните таблицу:
- 4. Открытие фтора Фтор(F2) –от греч. «фторос»- разрушающий был открыт в 1866 году французским химиком Анри Муассаном
- 5. Открытие хлора Хлор Cl2 от греч. «хлорос» - желто-зеленый 1774 год Шведский аптекарь Карл Вильгельм Шееле
- 6. Открытие брома Бром (Br2) от греч. «бромос»- зловонный Был открыт в 1826 году Французским химиком (24-летним
- 7. Открытие йода Йод (I2) от греч. «иодес» - фиолетовый Был открыт в 1811 году Французским химиком-технологом
- 8. Открытие астата Астат(At2) от греч. «астатос» - неустойчивый Был получен в 1940 году Искусственным путем при
- 9. Строение атомов галогенов F+9 ) ) 2 7 Cl+17 ) ) ) 2 8 7 Br+35
- 10. Физические свойства простых веществ-галогенов Бром Йод Хлор Астат
- 11. Возгонка йода Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое
- 12. Сравнение физических свойств простых веществ-галогенов F2 светло-желтый газ Cl2 желто-зеленый газ Br2 красно-бурая жидкость I2 темно-серые
- 13. Химические свойства фтора Взаимодействует со всеми металлами с выделением большого количества теплоты: с алюминием: 3F2 +
- 14. Химические свойства фтора Реагирует при облучении даже с инертными газами Xe + F2 → Xe F2
- 15. Химические свойства брома Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока. С
- 16. Химические свойства йода Химическая активность йода еще ниже, чем у брома. С металлами только при нагревании:
- 17. Вывод: химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может
- 18. Качественные реакции на галогенид-ионы Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl
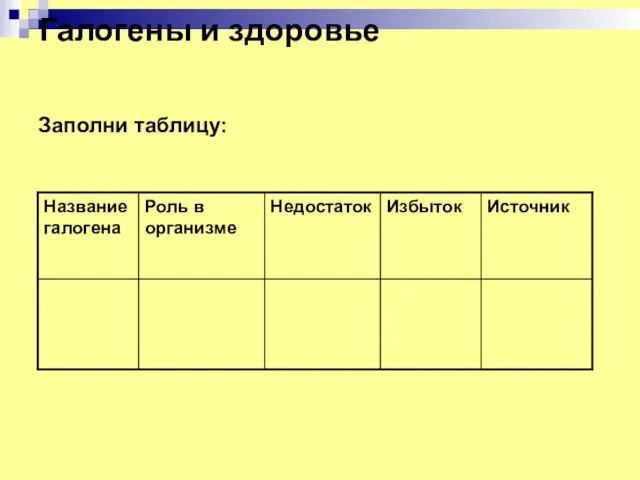
- 19. Галогены и здоровье Заполни таблицу:
- 20. Фтор и здоровье (суточная норма 2-3 мг) Роль в организме обеспечивает крепость костных тканей, правильный рост
- 21. Хлор и здоровье (суточная норма 2г) Роль в организме: Образование соляной кислоты, поддержание водно-электролитного баланса, выведение
- 22. Бром и здоровье (суточная норма 0,5-2 мг) Роль в организме: принимает участие в регуляции деятельности нервной
- 23. Йод и здоровье (суточная норма100-200 мкг) Роль в организме: Участие в синтезе гормонов щитовидной железы, создание
- 24. 2 е л е з о с м ь д й о в о а т
- 25. Домашнее задание § 31, упр.3,4,6,7,9,13(стр.151). При подготовке домашнего задания предлагаю вам заглянуть на мой сайт: https://sites.google.com/site/kazancevaevgenia/home
- 26. Использованные материалы http://ru.wikipedia.org – сведения о галогенах,15.10.2010, 31.10.2010 http://ru.wikipedia.org - портрет Бернара Куртуа,15.10.2010 http://ru.wikipedia.org - фото
- 28. Скачать презентацию























 Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Боевые отравляющие вещества
Боевые отравляющие вещества Классификация неорганических веществ. Оксиды и основания
Классификация неорганических веществ. Оксиды и основания Классы неорганических веществ (лекция № 4/5)
Классы неорганических веществ (лекция № 4/5) Констукционные и функциональные волокнистые композиты
Констукционные и функциональные волокнистые композиты Периодические системы химических элементов
Периодические системы химических элементов Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Алкины. Понятие алкинов. Формула алкинов
Алкины. Понятие алкинов. Формула алкинов Генетическая классификация горных пород
Генетическая классификация горных пород Токсикология и анализ спиртов
Токсикология и анализ спиртов Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Мембранное материаловедение
Мембранное материаловедение Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Оксиды. 9 класс
Оксиды. 9 класс Липиды и обмен липидов
Липиды и обмен липидов Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Водород
Водород Системы электрохимической защиты объектов трубопроводного транспорта. Нормативы
Системы электрохимической защиты объектов трубопроводного транспорта. Нормативы Нуклеиновые кислоты
Нуклеиновые кислоты Хроматографические методы анализа
Хроматографические методы анализа Тепловой эффект химических реакций
Тепловой эффект химических реакций Кристаллические решетки
Кристаллические решетки Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Химия в строительстве
Химия в строительстве История открытия натурального каучука
История открытия натурального каучука Физические и химические свойства воды
Физические и химические свойства воды