Слайд 2

Вода́ — неорганическое соединение с химической формулой Н2O. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета, запаха и вкуса. Около
71 % поверхности Земли покрыто водой(океаны, моря, озёра, реки, льды) — 361,13 млн.км2
Слайд 3
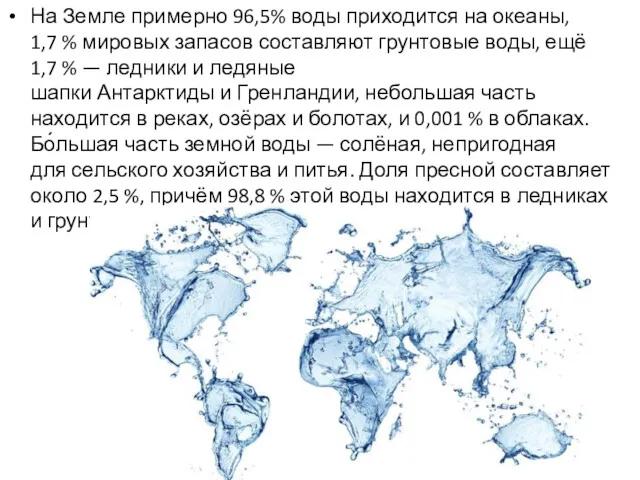
На Земле примерно 96,5% воды приходится на океаны, 1,7 % мировых запасов
составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах.
Слайд 4
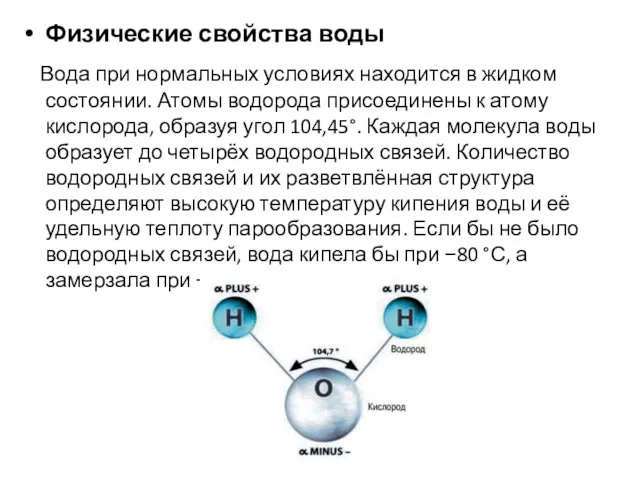
Физические свойства воды
Вода при нормальных условиях находится в жидком состоянии. Атомы водорода
присоединены к атому кислорода, образуя угол 104,45°. Каждая молекула воды образует до четырёх водородных связей. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования. Если бы не было водородных связей, вода кипела бы при −80 °С, а замерзала при −100 °С
Слайд 5

У воды самая большая удельная теплоёмкость, равная 4,187 Дж/(кг·К)
Для того чтобы
нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
Слайд 6

Вода является хорошим растворителем
Вода необходима для жизни всех без исключения одноклеточных и
многоклеточных живых существ на Земле
Чистая вода — хороший изолятор
В воде практически всегда растворены те или иные соли, благодаря чему вода проводит электричество; по электропроводности воды можно определить её чистоту
Вода сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта
Слайд 7

И кислород, и водород имеют природные и искусственные изотопы. В зависимости
от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Лёгкая вода (основная составляющая привычной людям воды)
Тяжёлая вода (дейтериевая)
Сверхтяжёлая вода (тритиевая)
Слайд 8

Химические свойства воды
Вода является наиболее распространённым растворителем на планете Земля. Её
иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). Вода — химически активное вещество. Молекулы воды образуют гидраты и кристаллогидраты.
Слайд 9

Гидролиз происходит в живой и неживой природе, и широко используется в химической
промышленности. Под воздействием очень высоких температур или электрического тока, а также под воздействием ионизирующего излучения вода разлагается на молекулярный кислород и молекулярный водород:
Слайд 10

Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 +
2NaOH (бурно)
Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)









 Элементы группы галогенов
Элементы группы галогенов Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Три кити нанохімії
Три кити нанохімії Углепластики
Углепластики Растворы. Концентрация растворов
Растворы. Концентрация растворов Арены. Бензол
Арены. Бензол Электролитическая диссоциация
Электролитическая диссоциация Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Закон сохранения массы вещества
Закон сохранения массы вещества Жесткость воды
Жесткость воды Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Склад і властивості нафти
Склад і властивості нафти Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Основания. Названия оснований
Основания. Названия оснований Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Обмен липидов-1
Обмен липидов-1 Химическая реакция. Признаки химической реакции. Химические и нехимические явления
Химическая реакция. Признаки химической реакции. Химические и нехимические явления Классификация и свойства оксидов
Классификация и свойства оксидов