Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) презентация
Содержание
- 2. Второе начала термодинамики и его применимость к биосистемам. Химическое равновесие Лекция №5 Лектор: кандидат химических наук,
- 3. I закон термодинамики позволяет определить ΔΗреакции, но не даёт ответа на вопрос о её направлении. Ответ
- 4. Второе начало термодинамики Энтропия (S) − мера рассеянной или обесцененной энергии. “Теплота сама по себе не
- 5. Второе начало термодинамики В самопроизвольном процессе В равновесном процессе Для изолированной системы, где Q = 0:
- 6. Статистическая природа S W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая
- 7. Лизосома Приложение 2-го начала к биосистемам Катаболизм в лизосоме
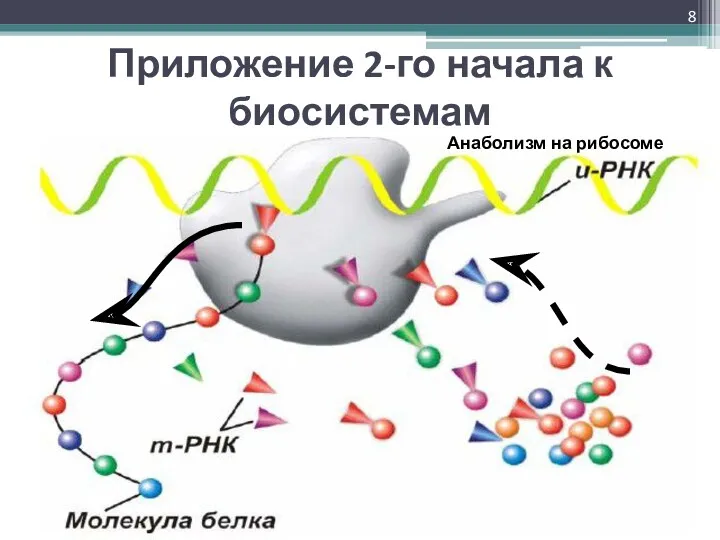
- 8. Приложение 2-го начала к биосистемам Анаболизм на рибосоме
- 9. Уравнение Гиббса… … является объединённым выражением I и II начал термодинамики. Для данной температуры ΔG =
- 10. Соотношение энтальпийного и энтропийного факторов
- 11. Реакции обмена Экзэргонические − реакции обмена, идущие с выделением энергии (ΔG Эндэргонические − реакции обмена, идущие
- 12. Макроэрги
- 13. Критерии равновесия Для обратимой реакции: aA + bB ↔ xX + yY при постоянном давлении и
- 14. Уравнение изотермы химической реакции Для процесса в общем виде: В положении равновесия: Якоб Хендрик Вант-Гофф (1852-1911)
- 15. Соотношение Пс и Кр
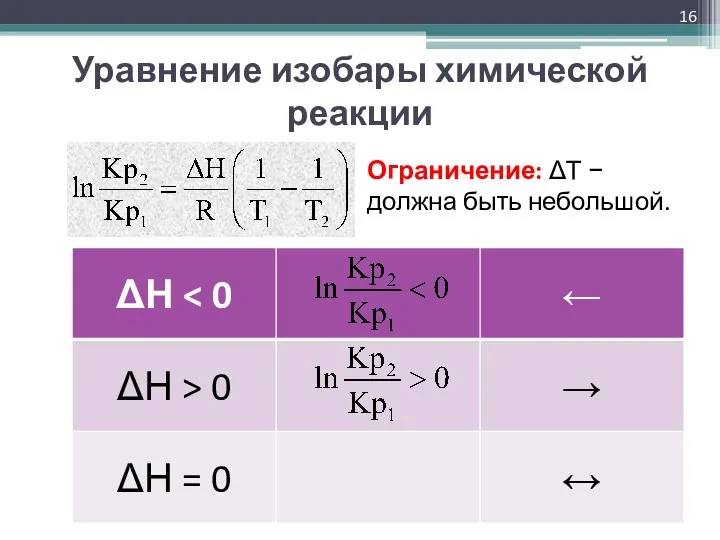
- 16. Уравнение изобары химической реакции Ограничение: ΔТ − должна быть небольшой.
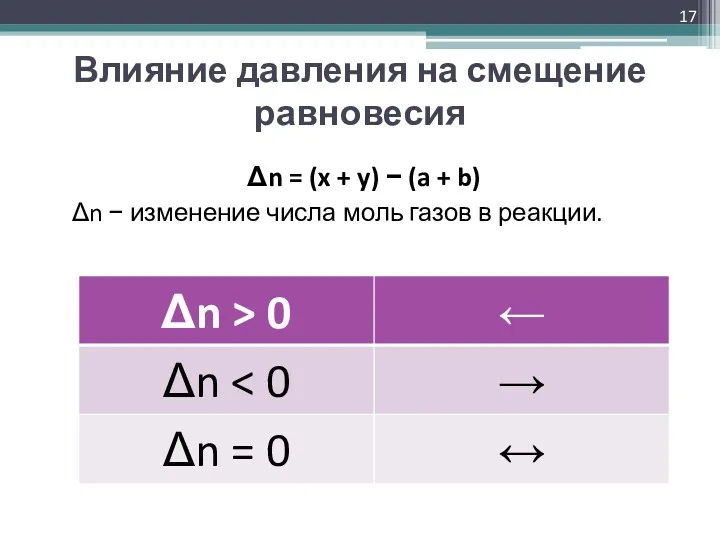
- 17. Влияние давления на смещение равновесия Δn = (x + y) − (a + b) Δn −
- 18. Принцип подвижного равновесия При изменении одного из условий химического равновесия оно смещается в сторону той реакции,
- 20. Скачать презентацию













 Химический элемент цинк
Химический элемент цинк ГИА-9 Химия. А10
ГИА-9 Химия. А10 Химические добавки к бетонам
Химические добавки к бетонам Химическая связь
Химическая связь Каучук
Каучук Расчеты, связанные с понятием доля
Расчеты, связанные с понятием доля Липиды. Составные части липидов
Липиды. Составные части липидов Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Щелочные металлы
Щелочные металлы Адсорбция. Раздел III
Адсорбция. Раздел III Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Алканы: метан, пропан, этан, бутан
Алканы: метан, пропан, этан, бутан Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Металлические стёкла
Металлические стёкла Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Строение атома
Строение атома Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Альдегиды и кетоны
Альдегиды и кетоны Силіцій
Силіцій Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Альдегиды и кетоны
Альдегиды и кетоны Сернистый газ. Сернистая кислота и её соли
Сернистый газ. Сернистая кислота и её соли Электролитическая диссоциация
Электролитическая диссоциация