Содержание
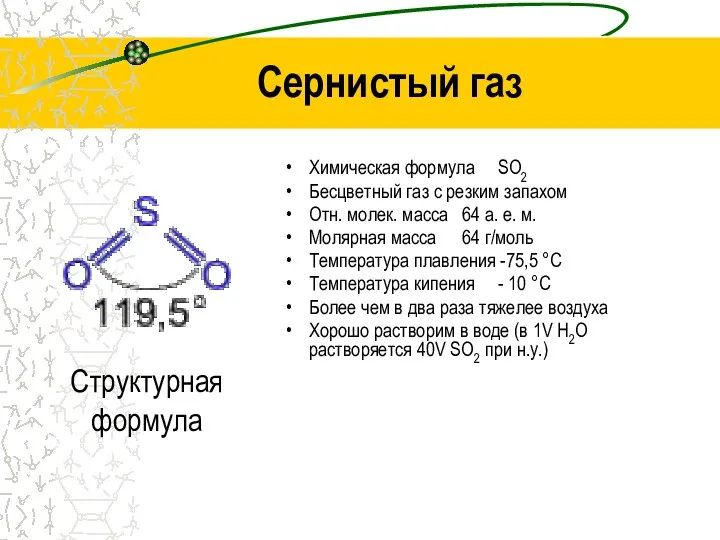
- 2. Химическая формула SO2 Бесцветный газ с резким запахом Отн. молек. масса 64 а. е. м. Молярная
- 3. Получение SO2 В промышленности: обжиг сульфидов: FeS2 + O2 → Fe2O3 + SO2↑ В лабораторных условиях:
- 4. Химические свойства Взаимодействие с водой При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3
- 5. Химические свойства Взаимодействие со щелочами: Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2O Ba(OH)2 + 2SO2
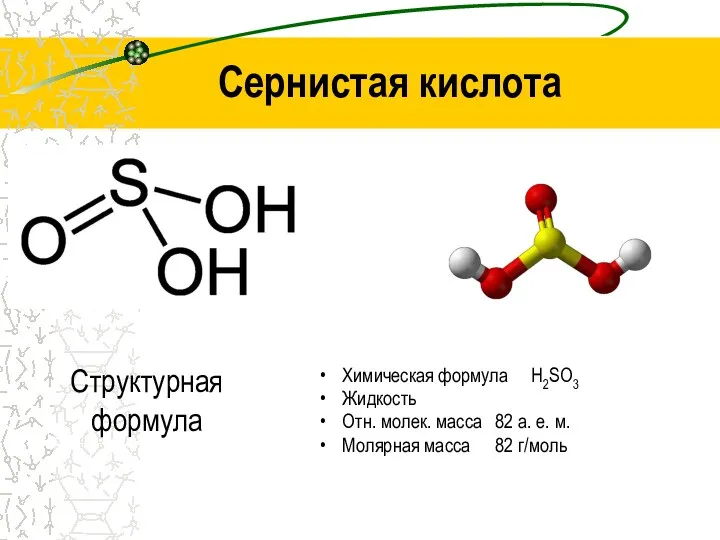
- 6. Химическая формула Н2SO3 Жидкость Отн. молек. масса 82 а. е. м. Молярная масса 82 г/моль Структурная
- 7. Химические свойства Сернистая кислота диссоциирует ступенчато: H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит –
- 8. Химические свойства Раствор сернистой кислоты обладает восстановительными свойствами: H2SO3 + I2 + H2O = H2SO4 +
- 9. Самоконтроль Осуществите превращения по схеме: S → H2S → SO2 → Na2SO3 → BaSO3 → SO2
- 11. Скачать презентацию






 Соединения алюминия
Соединения алюминия Занимательные опыты
Занимательные опыты Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Углерод и его оксиды
Углерод и его оксиды Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Растворение как физико-химический процесс
Растворение как физико-химический процесс Макро, микро и ультрамикроэлементы. Их роль
Макро, микро и ультрамикроэлементы. Их роль Нуклеин қышқылдары
Нуклеин қышқылдары Реакция горения. Класс 7
Реакция горения. Класс 7 Свойства органических соединений
Свойства органических соединений Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Определение магматических пород без микроскопа
Определение магматических пород без микроскопа Озон. Строние молекулы озона
Озон. Строние молекулы озона Энергетикалық деңгейлер
Энергетикалық деңгейлер История развития химии
История развития химии Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Карбоновые кислоты
Карбоновые кислоты Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Теория строения органических соединений
Теория строения органических соединений Химическая промышленность
Химическая промышленность Азот. Нахождение в природе
Азот. Нахождение в природе Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма
Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма Кристаллические решетки
Кристаллические решетки Энергетика химических процессов
Энергетика химических процессов Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Качественное определение химических элементов в почве
Качественное определение химических элементов в почве