Слайд 2

ТЕРМОХИМИЯ
Это раздел химии, изучающий тепловые эффекты химических реакций.
Эндотермические реакции
протекают с поглощением тепла.
Экзотермические реакции протекают с выделением тепла.
Слайд 3

ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Она рассматривает приложение термодинамических законов и принципов к химическим
процессам:
Исследует энергетические ресурсы системы;
позволяет рассчитать тепловой баланс реакций и тепловые эффекты
Слайд 4

Позволяет определить направление протекания процессов;
Так же позволяет учесть влияние различных факторов
на протекание реакций.
Слайд 5

ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Термодинамическая система- изолированная часть пространства ,содержащая совокупность тел или
тело с большим числом частиц.
Объекты природы , не входящие в систему, называют средой.
Слайд 6
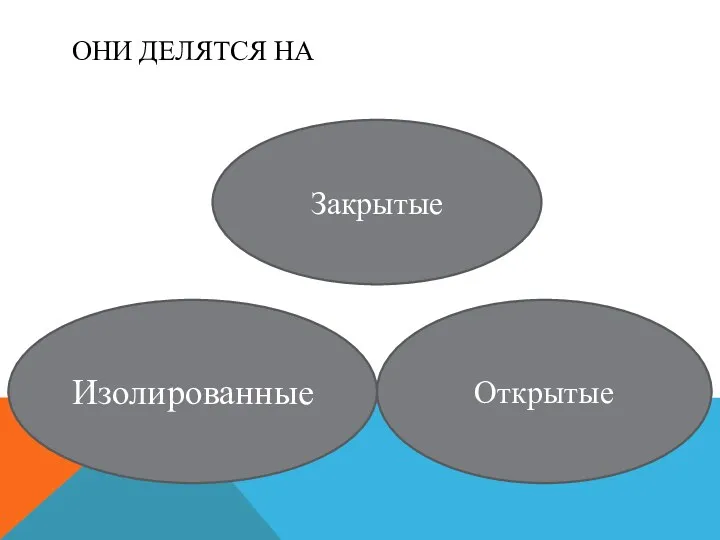
ОНИ ДЕЛЯТСЯ НА
Изолированные
Закрытые
Открытые
Слайд 7

Изолированная- система, у которой отсутствует масса и телообмен со средой.
Закрытая- система,
которая обменивается со средой энергией, но не обменивается веществом.
Открытая- система, которая может обмениваться со средой и веществом и энергией.
Слайд 8

ВИДЫ СИСТЕМ
Гомогенная система- она состоит из одной фазы.
Гетерогенная система- состоит из
нескольких фаз.
Слайд 9

Внутренняя энергия зависит от природы вещества, его количества, от его
условий существования.
При одинаковых условиях – энергия пропорциональна количеству вещества.
Слайд 10

ЭНЕРГИЯ ГИББСА
Самопроизвольное протекание изобарно – изотермического процесса определяется двумя факторами: энтальпийным,
связанным с уменьшением энтальпии системы (ΔH), и энтропийным TΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (ΔG):
Слайд 11

При постоянном давлении и температуре (р=const, T=const) реакция самопроизвольно протекает в
том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакция самопроизвольно протекает в прямом направлении.
Слайд 12

Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении
в данных условиях невозможно, а возможно протекание обратного процесса. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Слайд 13

При химическом взаимодействии одновременно изменяется энтальпия, характеризующая теплосодержание системы, и энтропия,
характеризующая стремление системы к беспорядку. Уменьшение энтальпии и рост энтропии – две движущих силы любого химического процесса.
Слайд 14

Вклад энтальпийного и энтропийного
Факторов в величину изобарно-изотермического потенциала во
многом определяется температурой:
При низких температурах преобладает энтальпийный фактор, и самопроизвольно протекают экзотермические процессы (DH<0);
При высоких температурах преобладает энтропионы фактор, и самопроизвольно протекают процессы, сопровождающиеся увеличением энтропии (DS>0).













 Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії Предмет органической химии
Предмет органической химии Кристаллическая структура твердых тел. Межатомные взаимодействия и классификация твердых тел
Кристаллическая структура твердых тел. Межатомные взаимодействия и классификация твердых тел Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия
Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия Углепластики
Углепластики Химическая технология органических веществ
Химическая технология органических веществ Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Хімія запаху і смаку
Хімія запаху і смаку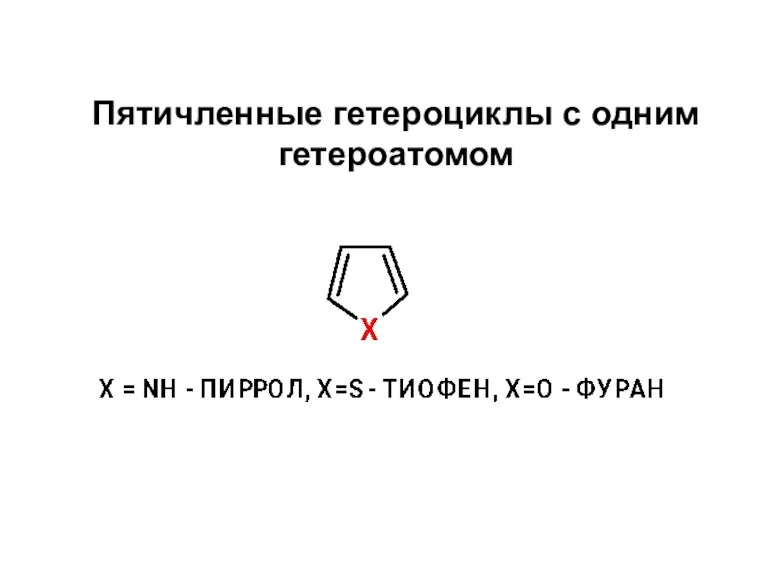 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Термодинамика химических процессов
Термодинамика химических процессов Процессы нитрования
Процессы нитрования Химия в косметологии
Химия в косметологии Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Химическая связь. Кристаллические решетки. (Лекция 2.2)
Химическая связь. Кристаллические решетки. (Лекция 2.2) Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Важнейшие минералы
Важнейшие минералы Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Химия и пища. Маркировка, упаковка пищевых и гигиенических продуктов
Химия и пища. Маркировка, упаковка пищевых и гигиенических продуктов СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Минеральные удобрения
Минеральные удобрения Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение